Материалы на данном сайте предназначены для врачей и специалистов в области медицины, некоторые изображения могут быть неприятны и вызвать шок. 18+
АВТОРЕФЕРАТ
Диссертации на соискание научной степени доктора медицинских наук
Куранов А.А.
Работа выполнена в Военно-медицинском институте ФСБ России
Начальник института Заслуженный врач России генерал-майор медицинской службы А.Н. Борисов
Научные консультанты:
доктор медицинских наук, профессор Анисимов Валентин Николаевич
доктор химических наук, профессор ДЕРГУНОВ Юрий Иванович
Официальные оппоненты:
член-корреспондент РАМН, доктор медицинских наук,
профессор СВЕТУХИН Алексей Михайлович
доктор медицинских наук, профессор АЗОЛОВ Вадим Владимирович
доктор медицинских наук, профессор КУДРЯВЦЕВ Борис Павлович
Ведущая организация:
Государственный институт усовершенствования врачей МО РФ – г. Москва
Защита диссертации состоится _______ 2005 года в ____ часов на заседании Диссертационного совета Д 208. 061. 01 при государственном образовательном учреждении высшего профессионального образования «Нижегородская государственная медицинская академия Министерства здравоохранения Российской Федерации (603005 г. Н. Новгород, пл. Минина, 10/1).
С диссертацией можно ознакомиться в библиотеке Государственного образовательного учреждения высшего профессионального образования «Нижегородская государственная медицинская академия Министерства здравоохранения Российской Федерации (603104, г. Н. Новгород, ул. Медицинская,3а).
Автореферат разослан «_____»_____________2005 года
Ученый секретарь
Диссертационного совета,
доктор медицинских наук, профессор
Паршиков В. В.
ОБЩАЯ ХАРАКТЕРИСТИКА ДИССЕРТАЦИИ
Актуальность. Лечение ран было и остается основной задачей хирургии, а ведение раны под повязкой по-прежнему является альтернативой кровавым хирургическим способам решения проблемы. Медицинские повязки сохраняют за собой приоритетное значение, несмотря на появление, весьма эффективных методов связанных с использованием изолированной абактериальной среды, ирригационно-аспирационного или дозированного вакуумного дренирования. Это связано с простотой и доступностью лечения ран под повязками в сложных условиях боевой обстановки и полевых лечебных учреждениях. Кроме того, упомянутые выше методы используются обычно в лечении определенной, чаще I фазы раневого процесса и не исключают полностью применения медицинских повязок (Адамян А.А., 1991, 2001; Азолов В.В. и соавт. 2004; Булынин В.И. и соавт., 1998; Ерюхин И.А., 1989; Кузин М.И., Костюченок Б.М., 1990; Кудрявцев Б.П., 2000; Назаренко Г.И., Глянцев С.П., 2002; Светухин А.М. и соавт, 2004; Рухляда Н.В. и соавт., 2003; Rees R., 2001; Thomas St., 1996; Young T., 1998).
На протяжении многих веков материалом для закрытия раневой поверхности служили, изготовленные из натурального хлопка или льна: корпия, вата, марля. Эти материалы хорошо защищают рану от воздействий внешней среды и проникновения микробов, обладают хорошей воздухопроницаемостью и умеренными абсорбционными свойствами. Вместе с тем, в литературе имеются многочисленные данные о том, что медицинская марля, широко используемая в виде ватно-марлевых или марлевых повязок, при достаточно длительном нахождении на ране, оказывает на нее травмирующее воздействие, замедляя процесс заживления. Марлевые повязки прилипают к ране, при их смене значительно повреждается нежный регенерат эпителия, нередко возникают повторные кровотечения. Само снятие повязки сопровождается сильной болью. Под пропитанными раневым отделяемым и потерявшими абсорбционные свойства марлевыми повязками часто развиваются скрытно протекающие нагноительные процессы. Наконец, большой расход, а, с другой стороны, дефицит и достаточно высокая стоимость марлевых перевязочных средств, возрастающая с каждым годом, не только сдерживают их широкое использование, но и заставляет изыскивать всевозможные искусственные заменители традиционных перевязочных материалов (Даурова Т.Т.и др., 1980; Адамян А.А., 1989, 2001; Добыш С.И., 1998, 2001; Abatangelo G., 1998; Csato P., 1968; Meylan G., Tschanc P., 2001; Nathan P. et al., 1982; Thomas S., 1990).
Совершенно неслучаен тот факт, что за последние годы поискам и внедрению новых перевязочных средств посвящено огромное количество публикаций, проведено четыре Международные конференции под общим названием "Современные подходы к разработке эффективных перевязочных средств", состоявшихся в Москве в 1992, 1995, 1998 и 2001 годах, что свидетельствует об актуальности этой проблемы (Адамян А.А., 2001; Носкова Т.И., Добыш С.И., 2001; Назаренко Г.И., Глянцев С.П., 2002).
До настоящего времени в мире не создана, так называемая «идеальная» повязка критерии, которой были сформулированы T. Turner в 1990 году.
Известно более трех десятков характеристик идеальной повязки (Назаренко Г.И., Сугурова И.Ю, Глянцев С.П., 2002). Приближенная к идеальной повязка должна, как минимум:
• создавать и контролировать оптимальную для заживления влажность раневой среды, сохраняя на поверхности раны минимально возможное количество клеточного детрита, раневого экссудата и микроорганизмов;
• обеспечивать и контролировать оптимальный газовый состав раневой среды, особенно содержание кислорода и углекислоты;
• поддерживать оптимальную концентрацию водородных ионов (рН) в ране;
• обеспечивать термоизоляцию раны от внешней среды;
• быть непроницаемой для микроорганизмов как со стороны раны (для предотвращения контаминации окружающей рану кожи), так и извне;
• быть нетоксичной по отношению к раневым клеткам и организму больного в целом, не содержать веществ или фрагментов, способных нарушать заживление;
• быть атравматичной, не вызывая при смене повязки боли или повреждения новообразованной ткани или эпителия (Даурова Т.Т. с соавт., 1980; Адамян А.А., 1989, 2001; Бухарин О.В., Усвяцов Б.Я.,1982; Добротина Н.А. с соавт., 1987; 2001; Ерюхин И.А.,1989; Носкова Т.И., Добыш С.И., 2001: Соболенко А.К. с соавт.,1993; Csato P.,1968; Kleczynsky S., 1989; Oluvasanmi J., Chvapil M., 1976; Nathan P. et al., 1982; Portych L.,1973; Ward H. e.a., 1985, Turner T., 1990).
В качестве одного из материалов, удовлетворяющих многим требованиям, предъявляемым к «идеальной» повязке, был предложен полиуретан (ПУ) виде тонких, заранее приготовленных и стерилизованных пластинчатых листов различных размеров и толщины. Подобного типа повязки были созданы в США (Milton W.F. e.a., 1970) и Великобритании (Lock P.M., 1976). Они успешно применялись во время Англо-Аргентинского конфликта в 1982 году (London P.S.,1983) в ожоговых центрах Великобритании (Poulsen T.D.at al., 1991). Как СИСпур-дерм (Германия), и Allevyn(Smith & Nepew) они изготавливались заранее, упаковывались и стерилизовались гамма-лучами. В нашей стране Научно-производственное объединение "Полимерсинтез" совместно с Всероссийским научно-исследовательским институтом медицинской техники и Институтом хирургии им. А.В.Вишневского разработали медицинские повязки из эластичного открытоячеистого пенополиуретана, стерилизованные радиационным методом и рекомендованные для использования в сочетании с мазями для проведения химической некрэктомии и в качестве безворсового сорбента (Крючков Ф.А., с соавт., 1989). Однако использование этих и подобных им материалов выявило существенные недостатки. Так повязки плохо прилегают к ране, требуется их фиксация к ней с помощью тех же марлевых бинтов (за исключением Allevyn), они не обладают достаточной абсорбционной емкостью, слабо защищают рану от вторичной микробной инфекции. В связи с этим повязки не получили большого распространения.
Совместно с химиками из НИИКарбамидопроект г. Дзержинска под руководством профессора, доктора химических наук Дергунова Ю.И. в 1989 нами было предложено использовать гелеобразную быстрозастывающую массу ППУ, образующуюся при смешивании ex tempore двух ее жидких исходных компонентов. Такая пенистая масса, самостерилизовалась в момент приготовления, была опробована нами в качестве новой оригинальной повязки для лечения больных с ожогами и ранами мягких тканей различной этиологии, но из-за высокой токсичности компонента Б от дальнейшего использования ее в медицинской практике пришлось отказаться.
Цель исследования: оптимизация лечения различных видов ран с помощью принципиально новой пенополиуретановой повязки, отвечающей большинству современных требований к перевязочным материалам и внедрение ее в клиническую практику.
Задачи исследования:
- Разработать принципиально новую пенополиуретановую повязку, отвечающую большинству современных требований к перевязочным материалам.
- Установить физико-механические и биологические свойства предложенной повязки.
- Определить возможности и перспективы улучшения этих свойств.
- Изучить в эксперименте на животных возможности использования повязки для лечения термических ожогов, округлых плоскостных и длительно незаживающих ран.
- Апробировать в клинических условиях эффективность использования повязки.
- Выработать показания и противопоказания к применению указанной повязки.
- Дать практические рекомендации по применению повязки «ЛОКУС» в различных фазах раневого процесса.
- Оценить возможности ее применения в военно-полевых и экстремальных условиях.
Научная новизна:
Разработана и внедрена в широкую клиническую практику новая пенополиуретановая повязка ПГБ «ЛОКУС». Впервые изучены физико-механические и биологические свойства предложенной повязки и показаны пути совершенствования этих свойств. Экспериментально-клинически обосновано ее применение в хирургии в зависимости от фаз раневого процесса при лечении больных с гнойными, огнестрельными, ожоговыми, длительно незаживающими ранами, трофическими язвами. Доказана ее высокая эффективность в лечении донорских ран, свищей желудочно-кишечного тракта, профилактики спицевых осложнения при использовании аппаратов внешней фиксации.
Теоретическая и практическая значимость работы:
Данные экспериментальных и клинических исследований способствовали расширению сферы применения пенополиуретановой повязки «ЛОКУС» в хирургии. Определились пути совершенствования гелеобразных пенополиуретановых повязок с приданием им новых свойств в зависимости от решаемых задач в различных фазах раневого процесса. Применение повязки «ЛОКУС» оптимизирует течение раневого процесса у больных с трофическими язвами, длительно незаживающими, ожоговыми, огнестрельными ранами, а также активно воздействует на раневой процесс у больных с сахарным диабетом, осложненным синдромом диабетической стопы, что позволяет сократить сроки лечения больных в 1,5-2 раза.
Полученные данные об эффективности применения повязки «ЛОКУС» при лечении огнестрельных ран позволяют рекомендовать ее к более широкому использованию в войсковом звене.
Положения, выносимые на защиту:
- Пенополиуретановая композиция, составленная по предложенному рецепту, является принципиально новой и может использоваться в качестве медицинской повязки, которая отвечает всем предъявляемым к ней требованиям.
- Пенополиуретановая повязка «ЛОКУС» может применяться во всех фазах раневого процесса.
- Применение повязки «ЛОКУС» эффективно:
4. Прямых противопоказаний к применению предложенной повязки нет, за исключением случаев анаэробной и синегнойной инфекции.
Апробация работы:
Материалы диссертации доложены и обсуждены на Международной конференции «Новые способы лечения ран» (Пущино, 1993). Нижегородской областной выставке "Медтехника-93". XXV юбилейной научно-практической конференции военных врачей (Н. Новгород, 1994). Сетевой конференции хирургов Министерства путей сообщения Российской Федерации: «Организация хирургической помощи на железнодорожном транспорте. Послеоперационное ведение больных» (Н.Новгород,1995). Юбилейной конференции профессорско-преподавательского состава Военно-медицинского института ФПС России, посвященной 30-летию Военно-медицинского факультета (Н..Новгород,1995). Юбилейной научно-практической конференции, посвященной 15-летию кафедры хирургии: «Актуальные вопросы организации хирургической помощи раненым в локальных военных конфликтах» (Москва, 1996). VI Всероссийском съезде травматологов и ортопедов России (Н. Новгород, 1997). Региональной научно-практической конференции хирургов и травматологов-ортопедов: «Актуальные вопросы военно-полевой хирургии» (Н. Новгород, 1997). Дорожной конференции хирургов Горьковской железной дороги: «Актуальные вопросы хирургии» (Н. Новгород, 1998). Научно-практической конференции профессорско-преподавательского состава Военно-медицинского института ФПС России, посвященной 80-летию Пограничных войск и Дню Победы, - Нижний Новгород, 1998 год. Научно-практической конференции медицинского состава ФПС России: «Современные методы лечения ран мягких тканей» (Н. Новгород, 2000). На семинаре «Актуальные вопросы военной медицины», проводимого в рамках Всероссийской выставки «Медицина + 2000» (Н. Новгород, 2000). Научно-практической конференции Федеральной пограничной службы России «Актуальные проблемы диагностики, лечения и реабилитации при боевых ранениях» (Н.Новгород 2001). На Международном конгрессе хирургов (Москва, 2003). На IV Международном конгрессе по пластической, реконструктивной и эстетической хирургии (Ярославль, 2003) На VIII Российском национальном конгрессе "Человек и его здоровье" (СПб 2003). На VII Научно-практической конференции хирургов Федерального управления «Медбиоэкстрем»: «Актуальные вопросы гнойно-септической хирургии (Саров, 2004).
Реализация работы:
По результатам работы подготовлены методические рекомендации для врачей «Применение двухкомпонентных пенополиуретановых повязок для лечения ожогов и ран мягких тканей» (1993), монография «Пенополиуретановая повязка «ЛОКУС» в хирургии» (2003). По теме диссертации опубликовано 28 работ, получено 3 патента на изобретения и три положительных решения на выдачу патента на изобретение, 11 удостоверений на рационализаторские предложения.
За разработку вопросов лечения ран мягких тканей присуждена премия Нижнего Новгорода в области медицины.
Результаты работы внедрены в работу хирургических отделений городских больниц №№ 12,13, 33, 35, 39, 40, ОКБ им. Семашко, ДКБ ГЖД (г. Н. Новгорода), ДКБ г. Самара, ДКБ г. Ростов на Дону, ДКБ г. Киров, Республиканском центре термических поражений им. Н.И. Атясова ННИИТО, Отделенческой больнице на ст. Владимир Горьковской железной дороги, Региональном госпитале №1 ПС ФСБ России в Республике Таджикистан, Гарнизонном госпитале МО России.
Способы лечения ран мягких тканей с использованием повязки «ЛОКУС» включены в учебную программу для слушателей и курсантов циклов усовершенствования врачей войскового звена ПС ФСБ России.
Объем и структура диссертации. Работа изложена на285 страницах текста набранного шрифтом Times New Roman, состоит из введения, обзора литературы, характеристики материалов и методов исследования, результатов экспериментальных исследований, данных собственных клинических наблюдений, обсуждения полученных результатов, выводов, практических рекомендаций и приложения. Диссертация включает 37 таблиц, 80 рисунков и диаграмм. Список литературы состоит из 534 источника, среди которых 359 отечественных и 175 иностранных авторов.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ
Работа является экспериментально-клиническим исследованием.
При ее выполнении было проведено 70 экспериментов с целью подбора оптимальной рецептуры повязки, 240 экспериментов на лабораторных животных, 560 цито-бактериологических исследований, изучено 840 гистологических препаратов.
Результаты экспериментальных исследований. Экспериментальная часть работы посвящена изучению физико-механических и биологических свойств пенополиуретановых рецептур, которые получались при химических опытах, проводимых с целью создания оптимального состава компонентов А и Б для новой пенополиуретановой повязки, а так же изучению процесса регенерации у животных с ожогами IIIA и IIIБ степени, округлых плоскостных ран и ран в условиях пониженного иммунитета на фоне аллоксанового диабета с использованием для этих целей пенополиуретановой повязки «ЛОКУС». В эксперименте на животных проверена эффективность лечебных свойств полученной повязки в лечении длительно незаживающих и ожоговых ран. Определено влияние новой повязки на микрофлору ран.
При выполнении экспериментов применялись следующие методики исследования:
1. Создание лабораторной модели раны из нативной плазмы для изучения физико-механических и биологических свойств пенополиуретановых композиций.
2. Термометрия и спектрометрия во время процесса полимеризации при получении повязки из пенополиуретана.
3. Хронометраж времени старта, подъема и отлипа, получаемых ППУ.
4. Изучение силы адгезии повязки.
5. Изучение влияния пенополиуретановых композиций на микроциркуляцию кожи на добровольцах с помощью лазерной доплеровской флоуметрии при помощи прибора ЛАКК – 01.
6 .Моделирование у животных округлой плоскостной, длительно незаживающей и ожоговой ран.
7. Визуальное изучение процесса заживления в ранах различной этиологии (очищение раневой поверхности от гнойно-некротических тканей, появление грануляционной ткани, начало эпителизации, полное заживление ран).
8. Гистологическое исследование тканей (округлой плоскостной, длительно незаживающей и ожоговой ран).
9. Цитобактериологические исследования мазков-отпечатков из ран.
10. Бактериологическое количественное и качественное исследование микрофлоры ран.
11. Планиметрическое исследование размеров ран в динамике.
12. Математическое планирование проведения экспериментов и математическая и статическая обработка полученных результатов.
Клиническая часть работы основана на изучении и лечении 875 больных с различной патологией, поступивших в хирургические стационары городских больниц Нижнего Новгорода, хирургического отделения отделенческой больницы на ст. Владимир, Региональный госпиталь №1 ПС ФСБ России в Республике Таджикистан в период с 2000 по 2004 годы.
Как известно в производстве ППУ используется реакция присоединения изоцианатов к полиолам. Примером такого изоцианата является толуилендиизоцианат (ТДИ) в виде смеси 2,4- и 2,6- изомеров (Рис. 1). При взаимодействии изоцианата с полиолами — высокомолекулярными органическими соединениями, имеющими активные функциональные гидроксильные группы ОН, образуется полиуретан, если изоцианат и полиол имеют более одной из указанных групп (Рис. 2.).

Рис. 1. Изомеры толуилендиизоцианата

ис. 2. Реакция синтеза полиуретана
В химической промышленности изоцианатный полупродукт называют компонентом Б, а полиольный полупродукт компонентом А, обычно он имеет в своем составе целый ряд необходимых и функционально оправданных добавок. Изоцианаты, или компоненты Б, как правило, не содержат других добавок.
Целью нашей работы было создание такого ППУ в получении которого, не использовался бы в качестве компонента Б (толуилендиизоцианат или ТДИ), который является высоко токсичным продуктом. Заменить толуилендиизоцианат решено, было на практически не токсичный полиизоцианат на основе дифенилметандиизоцианата (МДИ) (Рис. 3), что в свою очередь полностью должно было изменить состав компонента А.
Рис. 3. Химическая формула дифенилметандиизоцианата
Для решения задачи по созданию ППУ, где в качестве компонента Б использовался МДИ проведено было 7 серий опытов, по 10 опытов в каждой серии по установлению оптимального состава компонентов повязки. В табл. 1 указаны основные физико-механические параметры получаемых пен.
Таблица 1.
Сводные данные экспериментов по установлению оптимального
состава компонентов повязки
|
Номер серии |
Старт (сек) |
Подъем (сек) |
Отлип (мин.) |
Температура °С |
|
первая |
25 ± 2 |
140 ± 7 |
21 ± 3 |
50 ± 2 |
|
вторая |
10 ± 3 |
30 ± 5 |
5 ± 1,5 |
57,5 ± 0,5 |
|
третья |
22 ± 5 |
100 ± 12 |
16,5 ± 1,5 |
52 ± 1 |
|
четвертая |
35 ± 5 |
230 ± 15 |
35 ± 5 |
40 ± 1,5 |
|
пятая |
18 ± 4 |
80 ± 6 |
10,5 ± 1,5 |
54 ± 2 |
|
шестая |
13 ± 4 |
32 ± 5 |
9 ± 2 |
60 ± 1 |
|
седьмая |
20 ± 4 |
135 ± 15 |
20 ± 5 |
40 ± 1 |
В результате чего было установлено, что для создания гелеобразной пенополиуретановой повязки могут быть использованы: полиольный компонент А, содержащий высокомолекулярный простой полиэфирполиол, активационную смесь, включающую воду, катализатор уретанообразования и удлинитель цепи полиуретана, порооткрыватель, пеноотвердитель.
Изоцианатный компонент Б, содержащий олигоуретаноизоцианаты в избытке смеси изомеров дифенилметандиизоцианата. Выбрано соотношение компонента А и компонента Б которое близко к 3 : 1, что позволило получить гелеобразную быстрозастывающую повязку из эластичного пенополиуретана с оптимальными сроками ее полимеризации, температурного режима и следующими физико-механическими характеристиками:
Независимая токсикологическая экспертиза, подтвердила, что указанная повязка не токсична, и в момент смешивания самостерилизуется.
После получения пенополиуретана, с указанными выше составом и параметрами, мы изучили физико-химические и некоторые биологические свойства повязки на моделях раны. Для этого использовали нативную плазму крови с истекающим сроком годности. Нативную плазму для моделирования ран в условиях лаборатории мы взяли не случайно, так она наиболее по своим физико-химическим параметрам соответствует раневому отделяемому.
Плазму подкрашивали, метиленовым синим. Полученный состав наносили на полиэтиленовую пленку в виде «лужиц» различной формы. Затем на эти модели ран наносили полиуретановый гель. После окончательной полимеризации пенополиуретана и исчезновения остаточной липкости, полученную повязку снимали с полиэтиленовой пленки, при этом изучалась конгруэнтность повязки к рельефу и форме раны, степень адгезии, и глубина проникновения плазмы в толщу ППУ. Затем повязку разрезали в вертикальной плоскости.
Было установлено, что повязка имеет 4 функциональные зоны. Первая зона: внешний отвержденный слой, эта зона обладает отличными защитными свойствами от проникновения вторичной инфекции к ране. Вторая зона: эластичный основной пенополиуретановый слой, обладающий сорбционными и теплозащитными свойствами, куда проникает раневое отделяемое. Третья зона: зона адгезии, которая позволяет надежно фиксироваться повязке к любой сухой поверхности. Четвертая зона: слой, обогащенный полимочевиной, которая образуется за счет взаимодействия воды, содержащейся в нативной плазме, с изоцианатами. Именно - четвертая зона обладает наименьшей адгезионной способностью за счет полимочевин, что помогает спонтанному отделению уретановой повязки от раневой поверхности. Несмотря на ее гидрофобные свойства через нее осуществляется транспорт раневого отделяемого в эластичный губчатый слой, за счет микропор, связанных с каналами Плато-Гиббса.
При исследовании состояния капиллярного русла у 20 добровольцев был применен лазерный анализатор капиллярного кровотока ЛАКК – 01. С помощью, которого регистрировались и подвергались статистической обработке лазерные допплеровские флуограммы (ЛДФ – граммы) левых и правых областей до и после нанесения повязки «ЛОКУС» в левой паховой области. Повязка наносилась в гелеобразном состоянии в левой паховой области в виде «лепешки» диаметром до 20 см, толщиной до 1 см. Спустя 2 часа, после завершения реакции полимеризации проводилась ЛДФ по окружности повязки в левой паховой области и параллельно в той же проекции в правой паховой области. В табл. 3 представлены усредненные данные изменения ПМ у 20 добровольцев.
Таблица 3.
Изменения показателя микроциркуляции
в паховых областях
|
До нанесения повязки «ЛОКУС» в левой паховой области |
После нанесения повязки «ЛОКУС» в левой паховой области |
||
|
Левая паховая область |
Правая паховая область |
Левая паховая область |
Правая паховая область |
|
5,51±0,54 |
5,39±0,47 |
10,36±1,03 |
6,36±0,50 |
Из представленных в таблице данных отчетливо наблюдается увеличение капиллярного кровотока левой паховой области после нанесения повязки «ЛОКУС» в среднем в 1,9 раза.
Таким образом, полученный нами пенополиуретан обладает следующими медико-биологическими характеристиками: отличными изоляционными свойствами; хорошими сорбционными качествами; отсутствием адгезии к влажным поверхностям; хорошей адгезией к сухим поверхностям; не токсична; стерильна; обладает отличной конгруэнтностью к раневой поверхности, улучшает капиллярный кровоток.. Перечисленные свойства позволили нам предложить данную композицию в качестве новой пенополиуретановой повязки, на которую получено разрешение МЗ РФ на использование в медицинской практике и на промышленное производство. Разрешению Минздрава предшествовали экспериментальные исследования на животных и клинические испытания в 3-х ведущих научно-исследовательских учреждениях страны: Институте хирургии им. А.В. Вишневского, Институте скорой медицинской помощи им. Н.В. Склифосовского и Московской медицинской академии им. И.М. Сеченова.
Влияние повязок «ЛОКУС» на процесс заживления ожоговых ран. При лечении ожоговых ран с использованием повязки «ЛОКУС» имели место заметные сокращение сроков отторжения струпа, очищение ран от гнойно-некротических тканей, появление грануляционной ткани, начало эпителизации и полное заживление ран (табл.2-3).Так, полное очищение ран при ожогах III-А степени у животных основной группы наступало через 6,7 + 0,51 суток от времени нанесения травмы и через 12,7 + 0,56 суток у животных контрольной группы. При ожогах III-Б степени эти показатели соответственно составляли 12 ± 0,45 и 18 +0,5 суток.
ТАБЛИЦА 2.
СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ЗАЖИВЛЕНИЯ РАН ПРИ ОЖОГАХ IIIА СТЕПЕНИ
|
Критерии заживления ран |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Результат лечения в серии (сут) |
|
Очищение ран |
Контроль |
27 |
0,257 |
12,7± 0,56 |
|
Основная |
27 |
0,193 |
6,7± 0,51 |
|
|
Полное отторжение струпа |
Контроль |
25 |
0,366 |
11,7± 0,80 |
|
Основная |
25 |
0,274 |
6,7± 0,42 |
|
|
Появление грануляций |
Контроль |
23 |
0,237 |
9,7± 0,52 |
|
Основная |
23 |
0,183 |
4,7± 0,39 |
|
|
Начало эпителизации |
Контроль |
21 |
0,281 |
12,7± 0,61 |
|
Основная |
21 |
0,180 |
5,7± 0,41 |
|
|
Полное заживление ран |
Контроль |
17 |
0,537 |
19,7± 1,18 |
|
Основная |
19 |
0,286 |
10,7± 0,62 |
Статистически значимые различия Р=0,02
Таблица 3.
Сравнительная характеристика заживления ран при ожогах ШБ степени*
|
Критерии заживления |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Сроки появления критериев заживления, сут |
|
Очищение ран |
Контроль |
25 |
0,231 |
18 ±0,503 |
|
Опыт |
27 |
0,241 |
12 ± 0,456 |
|
|
Полное отторжение струпа |
Контроль Опыт |
23 25 |
0,337 0,451 |
16 ±0,734 11 ±0,325 |
|
Появление грануляций |
Контроль Опыт |
2 1 23 |
0,288 0,180 |
13 ± 0,627 4 ± 0,295 |
|
Начало эпителизации |
Контроль Опыт |
19 21 |
0,208 0,249 |
14 ± 0,454 7 ±0,632 |
|
Полное заживление |
Контроль Опыт |
15 19 |
1,163 0,331 |
39 ± 2,534 19 ± 0,721 |
Статистически значимые различия Р=0,02
При ожогах III-А степени у животных основной группы раны эпителизировались через 10,7 ± 0,62 суток, а в контрольной группе – через 19,7 ± 1,18 суток. При ожогах III-Б степени эти показатели составляли соответственно 19 ± 0,72 и 39 ± 2,5 суток.
Положительное влияние повязок «ЛОКУС» на процесс заживления ожоговых ран подтверждено и данными гистологических исследований срезов тканей, подвергшихся термическому воздействию. В исследованиях у животных контрольной группы при ожогах IIIА степени отмечался некроз эпидермального покрова, гомогенизация подлежащих отделов дермы с явлениями кариопикноза ее клеточных элементов, коагуляционный некроз корней волос с сохранением в большей части их очертаний, значительная оксифилия некротизированной части дермы. В дерме наблюдалось резкое набухание коллагеновых волокон с плохо различимыми границами между ними. Жировая клетчатка была интактной, ядра миоцитов и межклеточные границы сохранялись.
При ожогах IIIБ степени обнаруживалось повреждение всей толщи эпителиального покрова. Наблюдался коагуляционный некроз эпителия. Аналогичные процессы происходили и с волосяным покровом, причем очертания корней волос и волосяные луковицы нередко сохраняли свои очертания, но клеточные структуры их становились совершенно неразличимыми. Коагуляционный некроз захватывал и собственно дерму, где обнаруживались некротизированные клеточные элементы с явлениями резко выраженного кариопикноза. В большинстве срезов явления некроза дермы наблюдались вплоть до жировой клетчатки, а в ряде случаев отмечалось поражение и самой подкожно-жировой клетчатки).
Гистологическое исследование тканей ожоговых ран, лечившихся под повязкой «ЛОКУС» показало, что имела место картина сходная с ранее описанной. Отмечалось ускорение пролиферации клеточных элементов дермы, в основном за счет фибробластов. В целом же, отмечалось более раннее созревание соединительной ткани главным образом коллагеновых волокон. Анализ основных статистических показателей заживления ожоговых ран и данных гистологического исследования позволяет сделать ряд выводов.
Во-первых, закрытие ожоговых ран повязками «ЛОКУС», независимо от степени ожога, способствует более раннему очищению раневой поверхности от гнойно-некротических тканей.
Во-вторых, в результате применения повязок «ЛОКУС» происходит значительное сокращение сроков формирования и отторжения ожогового струпа, появления грануляционной ткани.
В-третьих, при использовании повязок «ЛОКУС» в лечении поверхностных и ограниченных по площади глубоких ожогов значительно сокращаются и сроки полной эпителизации раневой поверхности.
Влияние повязок «ЛОКУС» на регенерацию округлых плоскостных и длительно незаживающих ран.
При визуальном наблюдении за процессом заживления плоскостной округлой раны у здоровых животных выявлены следующие изменения. Сразу после нанесения рана несколько минут слабо кровоточила. В течение первых суток происходило увеличение ее площади приблизительно на 10% по отношению к исходной при минимальном кровотечении. На вторые сутки рана интенсивно сокращалась и становилась меньше исходной, в среднем, на 20% . Поверхность ее покрывалась нежной коричневой корочкой, кровотечение прекращалось. На третьи сутки обычно образовывался первичный коричневый струп толщиной до 3 мм, под которым происходила эпителизация раны в течение 7-10 суток. Позже первичный некротический струп либо отпадал с образованием в последующем вторичного струпа, либо сохранялся до полного заживления под ним кожного дефекта. Полная эпителизация округлой плоскостной раны у здоровых животных происходила неравномерно. Так, скорость эпителизации нарастала к концу первой недели, когда заживало, в среднем, 60% раневой поверхности. Затем этот процесс несколько замедлялся, что по-видимому, было связано с формированием плотного первичного струпа. За вторую неделю эпителизировалось еще 33% площади раны и лишь в последующие пять суток процесс заживления раны завершался. Аллоксановый диабет отягощал течение репаративных процессов замедлял очищение ран, рост грануляций и дальнейшую эпителизацию раневой поверхности у крыс. На второй день после нанесения раны больному животному, контракция ее была выражена незначительно и за первую неделю площадь раны уменьшалась лишь на 7-9% от исходной. Рана покрывалась фибринозным налетом, количество отделяемого увеличивалось. С 7-8 суток начиналось очищение ран от налетов и некротических тканей, процесс заживления ускорялся, образовывался струп, под которым и происходила дальнейшая эпителизация. Струп, как правило, был рыхлым, легко удалялся с образованием вяло-гранулирующего дефекта. Сравнительная характеристика результатов проводимого лечения с применением повязок «ЛОКУС» показана в таблицах 4-7. Наблюдения за самопроизвольным заживлением ран у здоровых животных и у крыс, больных аллоксановым диабетом, позволило сделать заключение о том, что избранная модель позволяет изучать влияние пенополиуретановых повязок на заживление длительно незаживающих ран и в определенной мере, по нашему предположению и трофических язв.
Таблица 4.
Сравнительная характеристика заживления округлых плоскостных ран
|
Критерии заживления ран |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Результат лечения в серии (сут) |
|
Начало очищения ран |
Контроль |
27 |
0,348 |
4,9 ± 0,787 |
|
Опыт |
27 |
0,211 |
3 ± 0,235 |
|
|
Полное очищение ран |
Контроль |
25 |
0,359 |
7,2 ±0,8 12 |
|
Опыт |
25 |
0,371 |
4,8 ± 0,542 |
|
|
Появление грануляц. ткани |
Контроль |
23 |
0,373 |
11, 5 ±0,843 |
|
Опыт |
23 |
0,306 |
5,7 ± 0,575 |
|
|
Начало эпителизации ран |
Контроль |
21 |
0,416 |
7,8 ± 0,942 |
|
Опыт |
21 |
0,327 |
5,1 ± 0,234 |
|
|
Полное заживление ран |
Контроль |
17 |
0,500 |
18,5 ±1,131 |
|
Опыт |
19 |
0,335 |
13,5 ±0,575 |
Статистически значимые различия Р=0,02
Таблица 5.
Сравнительная характеристика длительно незаживающих ран
|
Критерии заживления ран |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Результат лечения в серии (сут) |
|
Начало очищения ран |
Контроль |
27 |
0,200 |
7,2 ± 0,452 |
|
Опыт |
27 |
0,224 |
3,5 ± 0,252 |
|
|
Полное очищение ран |
Контроль |
25 |
0,289 |
10,0 ±0,653 |
|
Опыт |
25 |
0,260 |
4,0 ± 0,235 |
|
|
Появление грануляц. ткани |
Контроль |
23 |
0,371 |
19,6 ±0,840 |
|
Опыт |
23 |
0,423 |
11, 5 ±0,647 |
|
|
Начало эпителизации ран |
Контроль |
21 |
0,471 |
11,0 ±1,066 |
|
Опыт |
21 |
0,348 |
5,1 ±0,574 |
|
|
Полное заживление ран |
Контроль |
17 |
0,517 |
26,3 ± 1,171 |
|
Опыт |
19 |
0,455 |
20,3 ± 1,245 |
Статистически значимые различия Р=0,02
Таблица 6.
Динамика заживления округлых плоскостных ран
|
Сутки проведения планиметрии |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Контракция раны, в мм2 |
|
3-и |
Контроль |
27 |
1,037 |
166 ±2,331 |
|
Опыт |
27 |
1,925 |
128 ± 3,253 |
|
|
5-е |
Контроль |
25 |
1,087 |
133 ±2,459 |
|
Опыт |
25 |
1,869 |
102 ±3,255 |
|
|
7-е |
Контроль |
23 |
1,453 |
109 ±3,287 |
|
Опыт |
23 |
4,702 |
72 ± 3,245 |
|
|
15-е |
Контроль |
21 |
0,986 |
72 ±2,231 |
|
Опыт |
21 |
0,610 |
31 ±1,131 |
|
|
20-е |
Контроль |
17 |
0,320 |
20 ±0,723 |
|
Опыт |
19 |
0,320 |
0,29 ± 0,11 |
|
|
25-26-е |
Контроль |
15 |
0,494 |
0,97 ± 0,12 |
|
Опыт |
19 |
- |
- |
Статистически значимые различия Р=0,02
Таблица 7.
Динамика заживления длительно не заживающих ран
|
Сутки проведения планиметрии |
Группы животных |
Количество обследуемых животных |
Среднее квадратичное отклонение |
Контракция раны, в мм2 |
|
3-й |
Контроль |
25 |
1,839 |
184 ±4,159 |
|
Опыт |
27 |
0,835 |
172 ±1,585 |
|
|
5-е |
Контроль |
21 |
1,274 |
172 ±2,882 |
|
Опыт |
25 |
0,760 |
133 ±1,454 |
|
|
7-е |
Контроль |
19 |
1,055 |
151 ±2,387 |
|
Опыт |
24 |
1,869 |
115 ±3,542 |
|
|
15-е |
Контроль |
17 |
1,114 |
110 ±2,519 |
|
Опыт |
23 |
0,947 |
72 ± 2,342 |
|
|
20-е |
Контроль |
15 |
0,987 |
66 ± 2,232 |
|
Опыт |
21 |
0,219 |
15 ±0,160 |
|
|
25-е |
Контроль |
13 |
0,071 |
10 ± 0,142 |
|
Опыт |
19 |
— |
— |
|
|
30-е |
Контроль |
11 |
0,363 |
0,64 ± 0,18 |
|
Опыт |
19 |
— |
— |
Статистически значимые различия Р=0,02
Оценка результатов экспериментов в случаях с округлыми плоскостными и длительно незаживающими ранами осуществлялась по внешнему виду ран, по очищению их от некротических тканей, появлению и отторжению струпа, активизации роста грануляционной ткани, началу эпителизации, полному заживлению раневой поверхности, а также по поведенческим реакциям животных во время перевязок и между ними. Одновременно проводилось измерение степени контракции раневого дефекта в динамике. Измерение площади раневого дефекта в процессе репаративной регенерации ожоговых и длительно незаживающих ран проводилось по методу Л.Н.Поповой (1942) на 3,5,7,15,20,25 и 30 сутки, с определением величины относительного уменьшения размеров раны по формуле В.С.Песчанского (1976):
S0 – St
S = ───── x 100
S0
где S0 - начальная площадь раны;
St - площадь раны в день ее измерения.
Дополнительно определялась скорость заживления ран в мм2 в сутки по формуле А.Е.Троицы (1984):
S0 – St
V = ───── ,
n
где S0 - начальная площадь раны,
St - площадь ран в день ее измерения,
n - число дней.
Результаты экспериментов обработаны на IBM Pentium 4 c использованием пакета программ «СТАТИСТИКА 6.0» методом дисперсионного анализа по двухфакторной модели, а для попарного сравнения выбран критерий Ньюмена-Кейлса, при нормальном распределении значения данных. Статистически значимые различия Р=0,02.
РЕЗУЛЬТАТЫ ЛЕЧЕНИЯ БОЛЬНЫХ
После проведенной апробации метода в эксперименте на животных мы применили его в практике лечения ожоговых, постожоговых и длительно незаживающих ран, трофических язв, огнестрельных ран, пролежней, свищей ЖКТ, а так же в качестве средства для профилактики воспалительных изменений со стороны мягких тканей вокруг спиц для скелетного вытяжения, при применении аппаратов внешней фиксации.
Эта часть исследования основана на изучении результатов лечения 875 больных в возрасте от 1 года до 70 лет, находившихся на стационарном лечении в хирургических отделениях Республиканском ожоговом центре Нижегородского НИИТО МЗ РФ, Дорожной клинической на ст. Горький, Городской клинической больницы № 33 г. Н. Новгорода и I –го ордена Красной Звезды Военного госпиталя ФПС РФ в период с 2000 по 2004 год.
Результаты лечения больных с поверхностными ожогами.В ожоговых отделениях Республиканского Центра термических поражений МЗ РФ и отделении гнойной хирургии городской больницы № 33 пролечено 113 больных, у которых лечение ожогов проводилось под повязкой «ЛОКУС», 113 больных, находившиеся в контрольной группе, лечились обычными методами. Взрослых больных было 218 человека в возрасте от 15 до 70 лет, детей - 8 человек в возрасте от 5 мес. до 14 лет. Распределение больных в зависимости от степени тяжести поражения, от возраста и пола представлено в таблице 8.
Таблица 8.
Распределение больных в зависимости от глубины поражения, возраста и пола
|
Глубина ожога |
Возраст в годах |
Всего |
|||||||||||
|
До 14 |
15-30 |
31-40 |
41- 50 |
51-60 |
61-70 |
||||||||
|
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
||
|
Ожоги II степени |
3 |
1 |
25 |
7 |
16 |
6 |
11 |
7 |
9 |
11 |
7 |
11 |
114 |
|
Ожоги Ш А степени |
2 |
2 |
27 |
6 |
14 |
5 |
12 |
6 |
8 |
11 |
7 |
12 |
112 |
|
Итого |
5 |
3 |
52 |
13 |
30 |
11 |
23 |
13 |
17 |
22 |
14 |
23 |
226 |
Рис.5. Распределение больных по площади ожогов (1 - площадь менее 3%; 2 - от 3% до 5%; 3 – от 5% до 10%; 4 – от 10% до 15%)
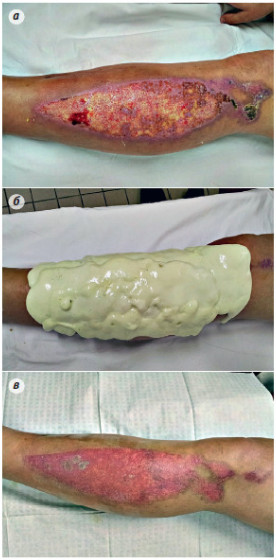
Имевшиеся у больных термические ожоги II-IIIA степени занимали площадь от 1 до 15% поверхности тела. Повязки «ЛОКУС» накладывались на ожоговые раны в сроки от нескольких часов до 15 суток, прошедших после получения травмы, однако, подавляющее большинство случаев наложения повязок (76,8%) приходилось на первые 2-3 суток, из них у трети больных повязки наложены в сроки от 2 до 24 часов после травмы. Время наблюдения за лечебно-защитным действием повязок «ЛОКУС» колебалось от 2 до 20 суток и зависело от ряда факторов (степени пропитывания повязок раневым отделяемым, адгезии ее к раневой поверхности и окружающей здоровой кожи, у 6 больных от применения «ЛОКУС» пришлось отказаться на вторые сутки из-за выраженного нагноения ран). Как и при использовании традиционных марлевых повязок, перед наложением на ожоговые раны повязки «ЛОКУС» осуществлялся тщательный туалет раневой поверхности, заключавшийся в удалении слущенного эпидермиса, обмывание раны антисептическими растворами (например,1% раствором детергента "Лотос" в равном соотношении с 3% раствором перекиси водорода), высушивание раны стерильными салфетками. Подобный же туалет ран производился и при смене повязок «ЛОКУС». Нанесение на ожоговые поверхности повязки «ЛОКУС» осуществлялось следующим образом. Жидкие ингредиенты (полиольный компонент А и изоцианатный -Б), являющиеся исходным сырьем для образования геля пенополиуретана, смешивались как уже описывалось выше, в прилагаемом пакете или какой-либо емкости (если размеры раны превышали 3 % поверхности тела) в условиях перевязочной непосредственно перед применением повязки. По завершении реакции полимеризации образовавшаяся, еще полужидкая, пенистая масса наносилась (методом выливания или выдавливания из мягкого полиэтиленового пакета) на ожоговую поверхность и за кромку окружающей здоровой кожи на 2 см, где и окончательно застывала. При этом хорошо заметен эффект растекания пенистой массы по поверхности раны. Вместе с тем, присущие пене адгезивные свойства помогают ей фиксироваться (приклеиваться) к подсушенной после туалета раневой поверхности и окружающей здоровой коже, что исключает необходимость ее дополнительной фиксации с помощью марлевых бинтов. Хорошая адгезия отмечена в 96% случаев. Наряду с этим отмечено, что застывшая повязка из пенополиуретана, будучи достаточно плотной и неподвижной, создает условия защитного комфорта для раны и больного. Надавливание на рану через повязку не вызывает у больного болезненности, исключается случайная травматизация раны при движении больного в кровати. Такое положительное свойство повязки отмечено у 91% больных. При смене или удалении повязок практически во всех наблюдениях отмечена высокая конгруэнтность повязки «ЛОКУС», позволяющая полностью заполнять все неровности рельефа ожоговой раны и обеспечивать, таким образом, плотное соприкосновение пенистой массы с поверхностью ожога. Это ценное качество, несомненно, обусловлено нанесением на рану ППУ в гелеобразном состоянии.
Повязка «ЛОКУС» больным с ожогами II ст. наносилась на следующий день после ожога. Производилось вскрытие пузырей и туалет ожоговой поверхности растворами антисептиков, кожа вокруг раневой поверхности высушивалась салфетками, после чего наносилась повязка. Из 57 наблюдений у 45 больных отмечена полная эпителизация под первичной, т.е. однократно наложенной повязкой, что составило 80 %. У 9 (15%) больных полное заживление произошло после повторного наложения повязки, у 3 (5%) больных – после трехкратного применения повязки «ЛОКУС». Различие в количествах перевязок у больных с ожогами II ст. в основном было связано с площадью ожогов.
Так в первой группе (45 человек) площадь ожогов была 3% поверхности тела, во второй группе (9 человек) площадь ожогов составила 5% п.т., в третьей (3 человека) – более 5% п.т. Во второй и третьей группе отмечалось самостоятельное отслаивание повязок в 1-2 сутки, что мы связывали с большим впитыванием раневого содержимого с большей площади раневой поверхности.
Из 56 больных с ожогами IIIA степени под однократно наложенной повязкой полная эпителизация отмечена в 17 наблюдениях, что составило 30% случаев. В 19 наблюдениях повязка накладывалась дважды, что составило 34%. В 11 наблюдениях производилась трехкратная смена повязок, что составило 20% случаев. У 9 больных, которым первоначально был диагностирован ожог IIIА степени при дальнейшем лечении и наблюдении были выявлены участки с ожогами IIIБ степени. Несмотря на глубину ожога, полная эпителизация раневой поверхности у этих больных была отмечена в 3-х наблюдениях при трехкратной смене повязок на небольших по площади участках, в 6 наблюдениях от дальнейшего использования повязок «ЛОКУС» пришлось отказаться из-за выраженного нагноения раны. В дальнейшем после полной очистки раневой поверхности от гнойно-некротических масс и переходе раневого процесса во 2-ю и 3-ю фазу повязка «ЛОКУС» применялась на небольших по площади участках до полной эпителизации. У всех больных после наложения повязок «ЛОКУС» осуществлялось наблюдение за внешним видом пенополиуретановой массы, степенью ее пропитывания раневым отделяемым, адгезивной устойчивостью на тех областях тела, где она была наложена, а также эффектом ее лечебного действия.
Критериями оценки эффективности комплексного лечения с применением повязок «ЛОКУС» служили: полное очищение раны от гнойно-некротических тканей и микробного загрязнения, начало и конец эпителизации. Эти данные представлены в табл. 9-10.
Таблица 9.
Сравнительные результаты лечения больных с ожогами II степени
|
Критерии заживления |
Группы больных |
Сутки появления (M ± m) |
|
Полное очищение ран |
Контроль (n=72) |
- |
|
Опыт (n=72) |
- |
|
|
Начало эпителизации |
контроль |
8,6 ± 0,37 |
|
опыт |
5,9 ± 0,32 |
|
|
Полная эпителизация |
контроль |
12,3 ± 0,69 |
|
опыт |
9,6 ± 0,55 |
Статистически значимые различия Р=0,02
Таблица 10.
Сравнительные результаты лечения больных ожогами IIIА степени
|
Критерии заживления |
Группы больных |
Сутки появления (M± m) |
|
Полное очищение ран |
Контроль (n=56) |
14,4 ± 0,37 |
|
Опыт (n=56) |
9,3 ± 0, 15 |
|
|
Начало эпителизации |
контроль |
17,0 ± 0,37 |
|
опыт |
14,5 ± 0,32 |
|
|
Полная эпителизация |
контроль |
25,5 ± 0,69 |
|
опыт |
18,5 ± 1,25 |
Статистически значимые различия Р=0,02
Одновременно у ожоговых больных изучалось проявление бактериостатического или бактерицидного эффекта пенополиуретановой композиции в опытах "in vitro" на жидких и плотных питательных средах. В качестве тест-микробов использованы стандартные штаммы гноеродной микрофлоры - стафилококка (штамм 600) и палочки сине-зеленого гноя (штамм Тесаков), выделенные от больных и полученные из коллекции института им. Тарасевича. Исследования не выявили непосредственного или отдаленного по времени бактерицидного и бактериостатического эффекта полимерной массы на микрофлору в лабораторных условиях. Наряду с этим у 27 больных проведены бактериологические, биохимические и иммунологические исследования, позволявшие оценить бактерицидное или бактериостатическое действие пены на раневую микрофлору и in vivo. Характеристика микрофлоры ожоговых ран представлена в табл. 11.
Таблица 11.
Характеристика микрофлоры ожоговых ран
|
Видовой состав микрофлоры |
Процент высевания |
Количество больных |
|
Staph. aurens |
19 |
5 |
|
Staph. epidermal. |
7 |
2 |
|
Прочие Гр+ кокки |
15 |
4 |
|
Ps. aeruginosa |
11 |
3 |
|
Proteus spp. |
4 |
1 |
|
Проч. Гр- палочки |
7 |
2 |
|
Микробные ассоциации |
30 |
8 |
|
Микрофлора не выделена |
7 |
2 |
|
Итого |
100 |
27 |
Как видно из данных, представленных в таблице, в микропейзаже ожоговых ран преобладали микробные ассоциации (30 %), из монокультур на первом месте Staph. aurens (19 %) - на втором Ps. Aeruginosa (11 %).
Бактериостатический эффект повязки изучался нами путем определения количества микрофлоры на 1 см 2 по методике Е.А. Федоровской и соавт. (1986). Материал для анализа забирался перед нанесением повязки из ППУ, а так же на 3; 5; 7 сутки после ее нанесения, результаты исследования представлены в табл. 12.
Таблица 12.
Динамика изменения количества микрофлоры на 1 см2 поверхности ожоговых ран под повязкой «ЛОКУС»
|
Сутки проведения исследований |
Количество обследуемых больных в % |
|||||
|
Количество микрофлоры на 1 см2 поверхности |
||||||
|
101 |
102 |
103 |
104 |
105 |
106 |
|
|
Перед нанесением повязки «ЛОКУС» |
2 |
5 |
13 |
60 |
15 |
5 |
|
3-и сутки |
15 |
40 |
20 |
20 |
3 |
2 |
|
5-е сутки |
43 |
47 |
6 |
3 |
1 |
|
|
7-е сутки |
55 |
42 |
2 |
1 |
|
|
Из представленных в таблице данных отчетливо выявляется эффект сдерживания колонизации микробов на поверхности ожоговых ран с уменьшением на 2-3 порядка количества инфекта на единице площади ран. Это можно объяснить, вероятно, тем, что пенополиуретановая повязка, обладая выраженным защитнопокровным действием, предохраняет ожоговую рану от вторичного микробного загрязнения. С оставшейся под повязкой первичной микрофлорой организм борется самостоятельно, активизируя местные и общие механизмы иммунитета. Нельзя исключить и механическое освобождение раны от микробов за счет абсорбционного действия пористой массы «ЛОКУС», а так же первичных бактерицидных свойств повязки при нахождении ее в фазе геля.
У 27 больных изучены в динамике ряд показателей иммунологического статуса организма. В одной группе больных (15 чел.) лечение ожоговых ран осуществлялось традиционным способом, в другой (12чел.) - с применением ППУ. Тестами иммунологического контроля служили подсчет в крови Т- и В-лимфоцитов, определение концентрации иммуноглобулинов различных классов, характер тканевоспецифических реакций, фагоцитарная способность нейтрофилов, по методу определения индекса завершенности фагоцитоза (Матусис З.Е., Пылаева С.И., 1972). В табл. 13 представлены лабораторные показатели состояния иммунной системы больных с ожогами.
Таблица 13.
Лабораторные показатели состояния иммунной системы у больных с ожогами
|
Иммунологические показатели |
Контроль(n=15) |
Опыт(n=12) |
|
Т- лимфоциты % |
55,9 ± 5,6 |
58,8 ± 7,1 |
|
В – лимфоциты % |
19, 9 ± 2,0 |
20,0 ± 2,6 |
|
Концентрация иммуноглобулинов Ig M Ig G Ig A |
1,2 ± 0,3 9,1 ± 0,2 0,7 ± 0,02 |
1,4 ± 0,6 8,7 ± 0,4 0,7 ± 0,03 |
|
Фагоцитарная способность нейтрофилов (ед) |
1,6 ± 0,6 |
3,9 ± 0,4 |
Статистически значимые различия Р=0,05
Таким образом, проведенные исследования показали, что иммунная система организма обожженных, лечившихся синтетическими повязками, не претерпевает каких-либо патологических изменений, возникновение которых можно было бы связать с действием ППУ на гомеостаз. Напротив, при лечении с помощью повязки «ЛОКУС» у больных отмечено явление стимуляции нейтрофильного фагоцитоза, что следует расценивать как положительный феномен, помогающий больным лучше справляться с микробной флорой, оставшейся на ожоговых ранах под повязками из ППУ. Это согласуется и с результатами бактериологических исследований, приведенных выше. Подводя некоторые итоги проведенных исследований, следует отметить, что пористое ППУ покрытие «ЛОКУС» отвечает большинству требований, предъявляемых к искусственным заменителям кожи. Эти требования предусматривают, как известно, хорошую адгезивную способность покрытия по отношению к здоровой коже, непроницаемость для микробов, воды, достаточную конгруэнтность, абсорбционность, а также способность содействовать более быстрому самоочищению ран и их заживлению. Положительными свойствами гелеобразующих ППУ композиций, использованных нами в качестве лечебно-защитных повязок при лечении больных с поверхностными ожогами II-IIIa ст., явились:
- выраженные адгезивные свойства повязок, позволяющие им прочно удерживаться на ране преимущественно за счет приклеивания к здоровой коже за пределами раны (исключается дополнительная фиксация бинтами);
- губчато-пористое строение ППУ массы повязки обеспечивает ей достаточно выраженные абсорбционные свойства, превосходящие таковые у традиционных марлевых повязок; эти свойства наряду с адгезивной способностью позволяют у 63 больных добиться заживления поверхностных ожоговых ран при однократном применении «ЛОКУС», а у 28 больных - после двухкратного наложения; в более редких случаях (у 16 из 113 больных ) потребовалось трехкратное наложение ППУ и у 6 больных лечение с ее помощью было признанным нецелесообразным до полного очищения ран (ожоги более глубокие, чем показалось при первичном осмотре, выраженное нагноение ожоговых
ран);
- высокая конгруэнтность пенистой массы повязки, наносимой на рану в полужидком состоянии, плотность контакта повязки со всей поверхностью раны независимо от ее локализации и сложности рельефа;
- достаточная плотность и одновременно длительно сохраняющаяся после наложения эластичность повязки, сообщающие ей выраженные покровно-защитные свойства, предохраняющие ожоговую рану от проникновения вторичной микробной флоры и случайной травматизации; эти положительные качества также способствуют заживлению ожоговых поверхностных ран под однократно наложенной повязкой;
- воздухопроницаемость и, вместе с тем, влагозащищенность повязки с наружной стороны, что делает её весьма удобной для лечения ожоговых ран, помогает исключить возникновение своеобразного "парникового" эффекта на раневой поверхности под наложенной повязкой;
- легкость, быстрота и безболезненность удаления повязки при отсутствии выраженного волосяного покрова вокруг раны кожных покровов.
Результаты лечения больных с длительно незаживающими ранами и трофическими язвами.
Лечение с использованием повязки «ЛОКУС» было применено у 449 больных с длительно незаживающими ранами (ДНР) и трофическими язвами (ТЯ). Из них ДНР наблюдались у 229 больных (51%), ТЯ у 220 больных (49%).
Распределение больных на группы в зависимости от характера патологического процесса, возраста и пола представлено в табл. 14.
Таблица 14.
Распределение больных в зависимости от характера патологического процесса, возраста и пола
|
Характер патологического процесса |
Возраст в годах |
Всего |
|||||||||||
|
до 30 |
31-40 |
41-50 |
51-60 |
61-70 |
71-80 |
||||||||
|
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
М |
Ж |
||
|
Длительно незаживающие раны |
49 |
7 |
38 |
9 |
36 |
5 |
28 |
11 |
17 |
12 |
5 |
12 |
229 |
|
Трофические язвы |
11 |
9 |
10 |
12 |
21 |
21 |
28 |
33 |
21 |
34 |
7 |
13 |
220 |
В зависимости от длительности существования кожного дефекта больные распределились следующим образом, табл. 15.
Таблица 15.
Распределение больных по длительности заболевания.
|
Характер |
Длительность заболевания |
||||
|
заболевания |
до 3-х мес. |
4-6 мес. |
7-12 мес |
до 2-х лет |
> 2-х лет |
|
ДНР |
160(70%) |
69(30%) |
|
|
|
|
ТЯ |
132(60%) |
35(15,9%) |
30(13,6%) |
19(8,6%) |
4(1,9%) |
|
ИТОГО |
292 |
104 |
30 |
19 |
4 |
В этой части исследования у больных с длительно незаживающими ранами и трофическими язвами дополнительно был проведен сравнительный анализ лечения, как традиционным способом, так и с применением повязки «ЛОКУС», а так же ксимедона и сочетания ксимедона и повязки «ЛОКУС». Для этого все больные были распределены на 4 группы, количественная характеристика представлена в табл.16.
Таблица 16
Распределение больных с ДНР и ТЯ по группам
|
Характер патологического процесса |
Количество больных |
||||
|
Традиционные методы |
Повязка «ЛОКУС» |
Ксимедон |
Повязка «ЛОКУС» + ксимедон |
Всего |
|
|
Длительно незаживающие раны |
57 |
61 |
53 |
58 |
229 |
|
Трофические язвы
|
55 |
59 |
51 |
55 |
220 |
В соответствии с задачами исследования нами оценивались результаты применения у больных с ДНР и ТЯ традиционных методов лечения, повязки «ЛОКУС», ксимедона в виде присыпки, под обычной марлевой повязкой, и ксимедона под повязкой «ЛОКУС». Больные были разделены на 4 группы с учетом возраста, пола и характера заболевания (см. таблицу 18). В первую группу вошли 112 больных, у которых применялось консервативное общепринятое лечение, включающее повязки с некролитиками, антисептическими растворами, различными мазевыми добавками.
Во вторую группу включено 120 больных, у которых лечение раневого дефекта осуществлялось под повязкой «ЛОКУС». В третью группу включены 104 человека, у которых применялся ксимедон в виде присыпки под обычной марлевой повязкой. 5-10% порошок ксимедона на тальке состоял из: ксимедона 5,0-10,0; талька 90,0-95,0. Ксимедон так же применяли в виде 10% мази, которой пропитывали марлевые салфетки. При выраженной экссудации осуществляли припудривание присыпкой из расчета 0,03 г на 1 см2поверхности раны из закрытой марлей банки, поворачивая ее вверх дном и постукивая пальцем по дну емкости. После того как экссудация уменьшалась, и появлялись грануляции, переходили на 10% ксимедоновую мазь. Частота смены повязки находилась в зависимости от ее промокания, обычно ежедневно, а на завершающем этапе – через 1-2 дня.
В четвертую группу включены 113 человек, у которых применялся ксимедон под повязкой «ЛОКУС». Ксимедон применялся аналогичным образом, как в третьей группе, но сверху на него наносилась повязка «ЛОКУС». Смена повязок осуществлялась до уменьшения экссудации через 1-2 дня, далее повязка менялась раз в 3 дня до появления признаков эпителизации, на завершающем этапе - один раз в неделю.
Лечение больных с длительно незаживающими ранами начиналось с изучения жалоб, анамнеза и общего состояния больного. В перевязочной оценивалось состояние ран, их внешний вид, локализация, размеры, глубина поражения, изменение кожных покровов вокруг раны. Перед наложением повязок производился посев отделяемого из раны для исследования на микрофлору и определения чувствительности микрофлоры к антибиотикам и антисептикам. Туалет раневой поверхности осуществлялся 3% раствором перекиси водорода или стерильным физиологическим раствором. Кожа вокруг раневого дефекта обрабатывалась спиртовым раствором хлоргексидина, после чего на раневую поверхность наносился пенополиуретановый гель, который растекался по раневому дефекту и за пределы его на 3-4 см.
Для оценки эффективности лечения учитывалось время ликвидации боли, отека, гиперемии, очищения раны, появления грануляций, начало эпителизации. Наряду с общепринятыми критериями оценки (сроки лечения и клинические данные), мы учитывали скорость очищения раневой поверхности от бактериального загрязнения, сроки появления грануляционной ткани, начало эпителизации и полное заживления кожного дефекта. Одним из важных показателей течения репаративных процессов является скорость уменьшения площади кожного дефекта в зависимости от сроков лечения (Камаев М.Ф.,1970;Gowland Hopkins N.F., Jamison C.W., 1983). Метод Л.Н.Поповой (1942) был применен и в случаях с длительно незаживающими ранами, и трофическим язвами. Исследования проводили на 5,10,15 и 20 сутки. Подсчитывалась средняя скорость заживления раны и средняя длительность лечения.
После применения повязки «ЛОКУС» отмечался эффект аналгезии спустя 2-3 часа, к третьим суткам ликвидировался отек и гиперемия. В контрольной группе стихание боли, отека и гиперемии отмечалось только к 11-14 дню лечения. После 2-3-х кратной смены повязки из ППУ раны очищались от некротических тканей, это соответствовало примерно 5 суткам от начала применения повязки, после чего начиналась активная эпителизация, что вело к сокращению размеров кожного дефекта, полное заживление наступало через 29,1 ± 2,1 суток. В отдельных случаях это приводило к отказу от проведения ранее запланированных кожно-пластических операций.
В случаях применения ксимедона в виде присыпки под марлевой повязкой ликвидация боли наступала к третьим суткам вместе с исчезновением отека и гиперемии, правда в первые часы после применения присыпки в ране появлялось чувство жжения, очищение ран наступало к 5,1 ± 3,8 суток, завершение эпителизации к 30,6 ± 2,1 суток. На завершающем этапе применялась 10% ксимедоновая мазь.
При использовании комплекса (Сарэл + ксимедон) боли стихали к исходу 1-х суток, а гиперемия и отек к исходу вторых суток. Очищение ран наступало в сроки 4,6 ± 2,7 суток, а завершение эпителизации – к 26,2 ± 3,4 суток.
В контрольной группе ликвидация боли, отека и гиперемии наступали к 12,6 ± 7,1 суток, очищение ран к 17,5 ± 6,3 суток, полное заживление за 62,2 ± 8,3 суток. Временные параметры эффективности лечения ДНР представлены в табл.17.
Таблица 17.
Эффективность лечения длительно незаживающих ран.
|
|
|
Сроки проявления клинических показателей (сут.) |
|||||
|
Методы лечения |
Число больных |
Ликвидация боли, отека, гиперемии |
Очищение раны |
Появление грануляций |
Начало эпитализа- ции |
Средняя скорость заживления в мм2/сут. |
Средняя длительность лечения |
|
Традици-онные |
57 |
12,6 ± 7,1 |
17,5± 6,3 |
19,4± 5,2 |
35,2± 8,7 |
12,5± 5,9 |
62,6± 8,3 |
|
Ксимедон |
53 |
2,7 ± 2,0 |
5,1 ± 3,8 |
8,1 ± 2,7 |
11,3 ± 3,8 |
49,8 ± 4,5
|
30,6± 2,1
|
Окончание табл. 17
|
Повязка «ЛОКУС» |
61 |
2,5 ± 2,1 |
4,9 ± 2,3 |
7,2 ± 2,5 |
10,2 ± 3,4 |
51,7 ± 3,7
|
29,!± 2,1
|
|
Повязка «ЛОКУС» + Ксимедон |
58 |
2,1 ± 1,8 |
4,6 ± 2,7 |
6,6 ± 3,3 |
9,4 ± 4,6 |
68,7 ± 3,6
|
26,2± 3,4
|
Различия достоверны (р=0,02) по сравнению с контролем.
Представленные здесь данные свидетельствуют о том, что повязка «ЛОКУС» не имеющая в своем составе лекарственных средств по своим лечебным свойствам не уступает лекарственному средству (ксимедону), а их совместное применение еще более благотворно влияет на улучшение условий для регенерации ран.
Особенности лечения трофических язв. Лечение больных с трофическими язвами является сложной и трудной проблемой, как для пациента, так и для врача. Самым важным залогом успеха в лечении такого больного является точное выяснение причины, вызвавшей появление этой язвы, и фона сопутствующих изменений в организме пациента (заболевания сердечно–сосудистой системы, диабет и т.д.). Амбулаторное лечение этого контингента чрезвычайно сложно ввиду ограниченности больных в движении, невозможности использовании комплексного воздействия на язву, включая физиотерапевтическое лечение, внутривенные инфузии, частые перевязки и хирургические методы лечения. Поэтому главное внимание уделялось лечению пациента в стационаре, где быстрее можно достичь радикального изменения клинической ситуации, а по мере уменьшения язвы в размере завершающий этап лечения больной может продолжить в условиях поликлиники.
Среди больных имевших трофические язвы основными причинами, приведшими к развитию данной патологию, были: варикозная болезнь, посттромбофлебитический синдром, диабетическая ангиопатия, облитерирующие заболевания сосудов. Поэтому лечение этой категории пациентов проводилось с учетом этиологического фактора и имело для каждого вида язв свои особенности.
Так для лечения трофических язв развившихся на фоне хронической венозной недостаточности для всех групп больных использовались рекомендации Орегонского протокола (1999 гКроме местного лечения всем больным с этой патологией назначались флеботоники, средства улучшающие реологию крови и микроциркуляцию, а так же применение гипербарической оксигенации (ГБО).
В группах больных с диабетическими язвами соблюдался принцип влажного заживления с соблюдением следующих условий – термическая изоляция, удаление избыточного экссудата, щадящие механические обработки, осторожное применение антисептических средств с возможным токсическим эффектом, средства улучшающие реологию крови и микроциркуляцию и ГБО. Особое внимание уделялось щадящей механической обработке ран. В этих группах больных мы полностью отказались от использования 3% перекиси водорода для промывания ран из-за ее цитотоксического эффекта на грануляционную ткань, фибробласты, способствующего в конечном итоге углублению раны. Эти же принципы применялись и для трофических язв, развившихся на фоне облитерирующих заболеваний сосудов.
Перед началом лечения во всех группах больных производился посев с поверхности язвы для определения характера микрофлоры, ее чувствительности к антибиотику. Посевы повторялись во время каждой перевязки.
Туалет раневой поверхности осуществлялся 3% раствором перекиси водорода с добавление раствора детергента или стерильным физиологическим раствором. Кожа вокруг раневого дефекта обрабатывалась спиртовым раствором хлоргексидина, после чего на раневую поверхность наносился пенополиуретановый гель, который растекался по раневому дефекту и за пределы его на 3-4 см, а при нанесении геля на трофические язвы в области лодыжек мы стремились, для более надежной фиксации к круговому охвату конечности.
Для оценки эффективности лечения, как и в случаях у больных с ДНР, учитывалось время ликвидации боли, отека, гиперемии, скорость очищения раневой поверхности от бактериального загрязнения, сроки появления грануляционной ткани, начало эпителизации и полное заживления кожного дефекта. Подсчитывалась средняя скорость заживления раны и средняя длительность лечения. Планиметрические исследования проводили на 3, 7, 14, 20, 25 и 30 сутки.
После применения повязки «ЛОКУС» отмечался эффект аналгезии, так же как и в группах больных с ДНР, спустя 2-3 часа, к пятым суткам ликвидировался отек и гиперемия. Здесь же необходимо отметить, что у некоторых больных с трофическими язвами развившимися на фоне ХВН отмечался эффект усиления болей в первые часы после нанесения ППУ, что заставляло нас в первое время отказываться от повязки «ЛОКУС» в I и начале II фазы раневого процесса. Первоначально повязка на трофические язвы у больных с ХВН применялась только в III фазе. После того как мы начали применять перед нанесением повязки аппликации на поверхность язвы марлевых салфеток, пропитанных 5% раствором лидокаина на 5-10 минут, больные перестали жаловаться на боли. При повторных перевязках болезненных ощущений у пациентов не было.
Эффект аналгезии при нанесении повязки «ЛОКУС» на трофические язвы, развившихся на фоне облитерирующих заболеваний артерий отмечался через 2 часа практически у всех больных, анестетики при этом не применялись.
В контрольной группе стихание боли, отека и гиперемии отмечалось только к 18 дню лечения. Очищение язвенных дефектов в группе, где применялась повязка «ЛОКУС» наступало через 7,3 ± 1,4 суток. Для очищения язв повязка наносилась в среднем до 3-х раз, после чего начиналась активная эпителизация, что вело к сокращению размеров кожного дефекта, полное заживление наступало через 32,4 ± 1,7 суток.
В случаях применения ксимедона виде присыпки и мази под марлевой повязкой ликвидация боли наступала к пятым суткам вместе с исчезновением отека и гиперемии, очищение язв наступало через 8,7 ± 2,9 суток, завершение эпителизации через 34,5 ± 6,8 суток.
При использовании комплекса (Сарэл + ксимедон) боли утихали к исходу 1-х суток, а гиперемия и отек к исходу 4-х суток. Зато очищение ран наступало в сроки 6,4 ± 2,1 суток, а завершение эпителизации через 30,6 ± 2,3 суток.
В контрольной группе ликвидация боли, отека и гиперемии наступали через 18,4 ± 3,6 суток, очищение ран через 19,6 ± 5,3 суток, полное заживление за 78,5 ± 8,2 суток. Временные параметры эффективности лечения ДНР представлены в табл. 18.
Таблица 18.
Эффективность лечения больных с трофическими язвами
|
|
|
Сроки проявления клинических показателей (сут.) |
|||||
|
Методы лечения |
Число больных |
Ликвидация боли, отека, гиперемии |
Очищение язвы |
Появление грануляций |
Начало эпитализа- ции |
Средняя скорость заживления в мм2/сут. |
Средняя длительность лечения |
|
Традиционные |
55 |
18,4± 3,6 |
19,6± 5,3 |
23,2 ± 5,5 |
38,6 ± 6,2 |
9,5 ± 4,4 |
78,5± 8,2 |
|
Ксимедон |
51 |
5,1 ± 1,6 |
8,7 ± 2,9 |
11,4 ± 4,3 |
14,2 ± 4,3 |
47,4 ± 4,1
|
34,5± 6,8
|
|
Повязка «ЛОКУС» |
59 |
4,9 ± 1,2 |
7,3 ± 1,4 |
10,6 ± 3,8 |
12,8 ± 2,7 |
52,5 ± 3,5
|
32,4± 1,7
|
|
Повязка «ЛОКУС» + Ксимедон |
55 |
4,3 ± 1,6 |
6,4 ± 2,1 |
8,5 ± 2,9 |
11,4 ± 4,1 |
53,7 ± 4,8
|
30,6± 2,3
|
|
Различия достоверны (р=0,02) по сравнению с контролем. |
|||||||
Результаты бактериологических исследований у больных с ДНР и ТЯ.
Количественно-качественный анализ микрофлоры длительно незаживающих ран и трофических язв проводился по методике, описанной выше. В результате применения повязок из пенополиуретана в комплексе лечебных мероприятий очищение раневой поверхности от бактериального загрязнения происходило через 4-5 суток от начала лечения. В контрольной группе даже к 25-27 дню у большинства больных не наступало полного очищения раневой поверхности. Это, в свою очередь, значительно удлиняло сроки заживления раневого дефекта.Частота высеваемости микроорганизмов с поверхности ДНР и ТЯ представлена в табл. 19.
Таблица 19.
Частота высеваемости микроорганизмов с поверхности ДНР и ТЯ.
|
Характер |
Частота высеваемости микроорганизмов в%. |
||||
|
патологии |
стафилококки |
cтрептококки |
Е.сoli |
ассоциация |
Роста нет |
|
ДНР |
48,2 ± 4,3 |
12,5 ± 5,6 |
4,2 ± 0,6 |
22,4 ± 2,6 |
12,7 ± 4,1 |
|
ТЯ |
45,7 ± 6,8 |
11,2 ± 3,4 |
4,6 ± 0,9 |
24,5 ± 3,8 |
14 ± 2,6 |
При исследовании на микрофлору с поверхности ран и язв стафилококк выделялся в 45-48% случаев, в 22-24% имелась микробная ассоциация, в 11-12% – стрептококк, в 4,6% – кишечная палочка и в 12-14% – роста не было.
86 больным до начала исследования и в процессе лечения проводили количественный учет аутофлоры с поверхности ран с подсчетом числа колоний на 1 см2. В ряде случаев при поступлении сосчитать колонии было невозможно из-за сплошного роста бактериальной флоры. Однако в среднем на 1 см2 число колоний было 139+8. Надо отметить, что физиологическая норма этого показателя весьма колеблется от 14 до 40 колоний на 1 см2. На это влияет множество внутренних и внешних факторов. Поэтому мы сочли возможным провести сравнение числа колоний на 1 см2 пораженного и симметричного здорового участка конечности. При этом на здоровых симметричных участках голени у 36 пациентов среднее количество колоний на 1 см2 равнялось 32+11,2. Это значение было принято нами за среднюю физиологическую норму для нашей категории больных. Полученные результаты приведены в табл. 20.
Таблица 20.
Влияния различных методов лечения на микрофлору длительно незаживающих ран.
|
Методы |
Число колоний на 1 см2 по дням наблюдений |
|||
|
лечения |
1-й день |
3-й день |
7-й день |
14-й день |
|
Традиционные |
134 + 4 |
136 + 5 |
150 + 6 |
104 + 4 |
|
Ксимедон |
140 + 3 |
45 + 2 |
______ |
______ |
|
Сарэл |
139 + 5 |
65 + 3 |
2 + 0,6 |
______ |
|
Сарэл + ксимедон |
144 + 3 |
12 + 0,5 |
______ |
______ |
При микробиологическом исследовании в раневом отделяемом чаще обнаруживался стафилококк, реже – стрептококк в ассоциации с другими микроорганизмами (кишечная, синегнойная, спороносная палочка и протей), которые обладали выраженной устойчивостью к антибиотикам.
Местное применение ксимедона оказывало влияние на качественный состав микробного пейзажа ран и язв. Имело место быстрое уменьшение бактериальной обсемененности раны, повышалась чувствительность к антибиотикам.
Повязка «ЛОКУС» также оказывала антимикробное действие.
К 8-10 суткам на отпечатках с поверхности ран встречались единичные колонии, происходило активное развитие грануляций на раневой поверхности, что позволило уменьшить количество перевязок до одного раза в неделю.
В контрольной группе больных, которым лечение проводили традиционными методами, снижение числа колоний отмечалось только на 10-14 день (103+4), а в первые дни после поступления в стационар обсемененность ран даже увеличивалась с 138+5 до 150+6 на квадратный сантиметр, что, как нам думается, связано с присоединением вторичной инфекции. Снижение количества колоний в этой группе до средних цифр происходило только на 32-52 сутки, когда уже раны хорошо гранулировали и начинали эпителизироваться с краев.
В результате проведенных исследований по изучению влияния избранных методов лечебного воздействия на микрофлору ДНР больных “in vitro”, были получены следующие результаты (табл. 21).
Таблица 21.
Влияние различных методов лечебного воздействия
на микробную обсемененность ДНР “in vitro”.
|
№ |
Лечебное |
Микробная обсемененность (на сутки исследования) |
|||
|
п/п |
воздействие |
1 сут. |
3 сут. |
7 сут. |
14 сут. |
|
1 |
Контроль |
Сплошной рост |
|||
|
2 |
Сарэл |
263,2±19,6 |
101,3±14,5 |
19,3±2,8 |
7,5±1,2 |
|
3 |
Ксимедон |
310,2±18,5 |
81,3±15,8 |
11,2±2,1 |
1,2±0,1 |
|
4 |
Сарэл + ксимедон |
247,6±21,3 |
42,8±2,9 |
2,8±0,9 |
Роста нет |
Эти данные свидетельствуют о том, что “in vitro” совместное воздействие присыпки ксимедон и повязки «ЛОКУС» на микробную обсемененность ДНР заметно усиливается. При этом в 38% случаев возбудителем гнойного процесса в длительно незаживающих ранах был золотистый стафилококк, в 19% – синегнойная палочка, 10% – кишечная палочка, 4% – протей, в 4% – клебсиелла, 4% – стрептококк, 0,5% – споровые сапрофиты, 0,5% – грибы Пенициллиум и в 21% – прочие микроорганизмы. Ассоциации выделяемых микробов встречались в различных комбинациях. Чаще всего золотистый стафилококк обнаруживался с грамотрицательными бактериями. Обнаруживали и ассоциации грамотрицательных видов: псевдомонас-эшерихии и протей-эшерихии. Доля микробных ассоциаций составила 45% случаев.
Результаты цитобактериологических исследований ДНР и ТЯ. Всего выполнено 280 цитобактериологических исследований.
При изучении цитологической картины мазков-отпечатков больных с ДНР после применения присыпки ксимедон на 3-и и 5-е сутки в ране отмечалось большое количество тканевых недифференцированных полибластов, фибробластов, лимфоцитов, макрофагов. Обнаружены микроорганизмы в состоянии завершенного фагоцитоза. Это характеризовало тип цитограммы как промежуточный (воспалительно-регенеративный). На 14-е сутки после воздействия ксимедона отмечалось уменьшение количества нейтрофилов, около половины клеток составляли тканевые недифференцированные полибласты, фибробласты и макрофаги. Также отмечалось наличие молодых клеток грануляционной ткани и единичные эпителиальные клетки, что характеризовало тип цитограммы как регенераторный.
Цитологические исследования раневых отпечатков после применения повязки «ЛОКУС» на 5-е и 7-е сутки свидетельствовали о более выраженном влиянии ППУ на регенерацию соединительной ткани. В процессе лечения повязкой «ЛОКУС» четкая положительная динамика состава отпечатков указывала на трансформацию клеточной реакции в регенеративно-воспалительный тип. На 14-е сутки резко уменьшалось число микробов, нейтрофилов и их дегенеративных форм – с 92% до 52%. Появлялись позитивные клеточные элементы (фибробласты, профибробласты, макрофаги), участвующие в процессе коллагенообразования и в фагоцитозе.
При комплексном воздействии («ЛОКУС» + ксимедон) на 3-и сутки цитограмма характеризовалась как дегенеративный тип клеточной реакции. Преобладали дегенеративные нейтрофилы, реже встречались палочкоядерные и сегментоядерные формы в незначительном количестве встречались тучные клетки. На 5-е и 7-е сутки цитограмма характеризовалась регенеративным типом клеточной реакции. Общее число нейтрофилов уменьшилось в 3 раза. Регенеративные формы преобладали над дегенеративными. Так же, как и в цитограммах, после воздействия ксимедоном появлялись позитивные клеточные элементы, гистиоциты, фибробласты. Имелись неклеточные элементы в виде глиальных волокон. Такая цитологическая картина свидетельствовала о созревании молодой грануляционной ткани.
В цитограммах контрольной группы до 14-х суток наблюдения продолжал оставаться дегенеративно-воспалительный тип воспаления с большим количеством фагоцитирующих нейтрофилов во всех полях зрения раневых отпечатков. Длительное время на цитограммах выявлялись клетки Унна, являющиеся плохим прогностическим признаком течения репаративного процесса.
Анализ полученных данных показал, что ППУ обладает хорошей бактерицидной активностью, будучи примененным как в чистом виде, так и в комплексе с ксимедоном.
Применение повязки «ЛОКУС» для лечения огнестрельных ран. Эта часть исследования проводилась на базе 1-го ордена Красной Звезды Военного госпиталя ПВ ФСБ РФ. Представленные нами данные основывались на изучении историй болезни раненых, которые были военнослужащими по призыву, выполнявшими служебно-боевые задачи на территории республики Таджикистан, и находились практически в одной возрастной группе.
Распределение раненых по полу и возрасту представлено в табл. 22.
Таблица 22.
Распределение раненых по полу и возрасту (абс.)
|
№ п/п |
Возраст, лет пол |
18-25 |
26-35 |
36-45 |
46-55 |
55 и более |
Всего |
|
|
Мужчины |
13 |
5 |
1 |
- |
- |
19 |
|
|
Женщины |
1 |
- |
- |
- |
- |
1 |
|
|
ВСЕГО: |
14 |
5 |
1 |
- |
- |
20 |
В структуре, отобранного для изучения контингента, преобладали огнестрельные (пулевые или осколочные) ранения мягких тканей конечностей без нарушения целостности костей (или с неполными краевыми переломами) - 60%. Второе место занимали минно-взрывные ранения с множественными осколочными повреждениями мягких тканей тела – 30% . На долю огнестрельных (пулевых, осколочных) ранений мягких тканей других областей тела приходилось 10% от общего числа анализируемых пострадавших. Состав анализируемой группы по локализации и характеру полученных ранений в процентном отношении представлен на и в табл. 23.
ТАБЛИЦА 23.
Характер повреждений у раненых анализируемой группы (абс.)
|
№ п/п |
Характер и локализация повреждений |
Количество |
|
|
Огнестрельные (пулевые или осколочные) ранения мягких тканей нижних конечностей: - бедра; - голени; - стопы. |
3 4 2 |
|
|
Огнестрельные (пулевые или осколочные) ранения мягких тканей верхних конечностей: - плеча; - предплечья; - кисти. |
1 1 1 |
|
|
Огнестрельные (пулевые или осколочные) ранения мягких тканей других областей тела без повреждения костей. |
2 |
|
|
Минно-взрывные ранения (МВР) с множественными осколочными повреждениями мягких тканей тела. |
6 |
|
|
ВСЕГО: |
20 |
Сроки поступления пострадавших на этап квалифицированной хирургической помощи после получения ранения представлены в табл. 24.
Таблица 24
Сроки поступления пострадавших на этап квалифицированной хирургической помощи после получения ранения (%)
|
Время (часы)
Показатель |
до 12 |
12 -24 |
24-48 |
свыше 48 |
Всего |
|
% |
6,6 |
26,6 |
23,3 |
43,5 |
100 |
Первая помощь была оказана в подавляющем большинстве случаев сразу после получения ранения в порядке само- и взаимопомощи, помощь в объеме доврачебной составила 5%, а первая врачебная - 36,6% от анализируемого контингента.
Первая врачебная помощь не оказывалась части раненым, которые в силу различных причин доставлялись сразу на этап квалифицированной хирургической помощи (центральные районные больницы в местах дислокации частей, медицинские пункты пограничных отрядов, усиленные группами специалистов хирургического профиля, военный госпиталь города Душанбе). Всем раненым с боевыми повреждениями после поступления выполнялась первичная хирургическая обработка, в послеоперационном периоде проводилось: местное и физиотерапевтическое лечение ран, назначались антибиотики, симптоматическая и инфузионная терапия.
Анализ историй болезней и клинических наблюдений показал, что у всех изучаемых нами раненых, причиной образования ДНР были гнойные осложнения, после проведенной первичной хирургической обработки в поздние сроки, свыше 48 часов от момента ранения, что составило 43,5 %.
Повязка «ЛОКУС» применялась для лечения 20 раненых, у которых имелись ДНР со сроком существования от момента ранения более месяца. Эти раны в большинстве своем имели характерный вид: подрытые края, дно покрыто фибринозным налетом серого цвета, грануляции синюшно-багрового цвета, серозно-гнойное отделяемое. Перед наложением повязки «ЛОКУС» проводилось промывание ран мыльным раствором с 3% перекисью водорода 1:1, очищение дна раны проводилось марлевыми шариками и повторным промыванием раствором диоксидина, кожа вокруг ран обрабатывалась спиртовым раствором хлоргексидина, затем наносился ППУ по методике описанной выше. После 2-3-х кратной смены повязки «ЛОКУС» раны очищались от некротических тканей, это соответствовало примерно 5 суткам от начала применения повязки, после чего начиналась активная эпителизация, что вело к сокращению размеров кожного дефекта, полное заживление наступало примерно через месяц.
Таким образом, применение повязки «ЛОКУС» оказалось эффективным и у этой категории пострадавших.
Применение повязки «ЛОКУС» для лечения пролежней.
Хорошо зарекомендовала себя повязка «ЛОКУС» и для лечения пролежней, причиной которых всегда является то или иное давление на мягкие ткани.
Способ лечения пролежней с помощью повязки «ЛОКУС» нами был опробован у 20 больных. В контрольной группе было такое же количество больных с аналогичными по локализации и площади пролежнями, того же возраста, что и в основной группе. Лечение больных в контрольных группах проводилось по методике указанной выше.
Всем больным, которым накладывали повязку «ЛОКУС», так же проводили полный комплекс общих противопролежневых мероприятий, как и в контрольных группах.
При наложении повязки в первой стадии, у 5 больных, отмечалось исчезновение гиперемии на 2-е сутки. Затем наносилась повязка на это же место до окончания лечения в стационаре или до того момента, когда больной начинал более активно двигаться. При этом прогрессирования развития пролежня не отмечалось, по-видимому, наша повязка выполняла в данном случае защитную роль, уменьшая степень давления на область, где начал образовываться пролежень.
Во второй стадии развития пролежня, также применяли повязку «ЛОКУС» в 4-х случаях после хирургической некрэктомии в качестве защитной повязки на зашитую после иссечения рану, во всех 4-х случаях мы отмечали заживление раны при однократном применении повязки.
Одиннадцать больных лечились с помощью повязки «ЛОКУС» во второй и третьей стадии развития пролежней.
В 3-х случаях, во второй стадии наша повязка исполняла роль вторичной повязки для проведения химической некрэктомии, повязку мы наносили вторым слоем на 40% салициловую мазь. В 2-х случаях мы использовали нашу повязку для проведения ферментной некрэктомии, здесь наша повязка также применялась в качестве вторичной окклюзирующей повязки, что способствовало регидратации и более быстрому отхождению струпа. В одном случае повязка «ЛОКУС» использовалась как средство аутолитической некрэктомии.
После полного очищения пролежней от некрозов, в случаях химической, ферментативной и аутолитической некрэктомии, а также в 5-ти случаях после хирургической некрэктомии повязка наносилась уже в качестве первичной до самого окончания лечения. Смена повязки осуществлялась по мере ее пропитывания раневым отделяемым и отслаивании от раневой поверхности, в среднем 3-4 раза во второй стадии развития пролежня. В третьей стадии развития пролежня повязка «ЛОКУС» наносилась 2 раза неделю до появления признаков эпителизации, после чего повязка менялась 1 раз в неделю.
После применения повязки «ЛОКУС» в III стадии развития пролежня к седьмым суткам ликвидировался отек и гиперемия кожи вокруг него. В контрольной группе исчезновение отека и отмечалось только через 3 недели. Образование грануляций в группе, где применяли ППУ, завершалось к концу второй недели – в контрольной группе спустя 1,5 месяца. Начало эпителизации в случаях использования повязки «ЛОКУС» отмечалось через 21,4 ± 3,3 суток – в контрольной группе через 75,4 ± 5,3 суток. Полное заживление в основной группе наступало через 37,3 ± 2,1 суток. В контрольной группе окончательное заживление пролежней, по имеющимся историям болезни, было прослежено только у 25% больных, остальные больные были выписаны из стационара домой или переведены в лечебные учреждения по уходу. Сроки заживления у прослеженных больных доходили до 5 месяцев.
Возможности применения повязки «ЛОКУС» для лечения донорских ран. Пересадка собственной кожи после глубоких ожогов для закрытия обширных гранулирующих ран является одним из надежных методов лечения ран и профилактики рубцовых деформаций.
Применение повязки «ЛОКУС» для закрытия донорских ран позволило по-новому подойти к решению вопроса улучшения заживления таких ран (заявка на изобретение № 203101199).
После взятия кожного трансплантата дерматомом и гемостаза готовили пенополиуретановую повязку по изложенному выше способу. Повязка «ЛОКУС» на донорской ране формировалась следующим образом. Сначала на здоровую кожу на расстоянии 2-3 см от края раны по периметру наносился пенополиуретановый гель, а затем гель наносился на саму рану, толщина повязки при этом должна была быть не менее 0,8-1,2 см.
Нанесение повязки в такой последовательности объясняется тем, что если выливать полиуретановый гель сразу на раневую поверхность, то он будет скатываться с поверхности раны из-за капелек «кровяной росы». При создании полиуретанового валика по периметру раны скатывания геля не будет, что значительно уменьшает расход материала. Если повязка не отслаивалась от поверхности раны и хорошо фиксировалась к здоровой коже, то она оставалась на ней до ее полной эпителизации, т.е. 9 -10 суток, причем по окончании эпителизации повязка отходила самостоятельно и безболезненно.
Способ лечения донорских ран с помощью повязки «ЛОКУС» нами был опробован у 40 больных. В контрольной группе было такое же количество больных с аналогичными донорскими ранами по локализации и площади, того же возраста, что и в основной группе. Лечение больных в контрольных группах проводилось общепринятыми способами.
Все больные, которым была наложена повязка «ЛОКУС», отмечали полное отсутствие боли и чувства стягивания раны. На следующие сутки после операции больные были активны, повязка им не мешала ходить, дополнительного ухода за ней не требовалось. В одном случае из 40 пришлось сменить повязку в тот же день после операции из-за ее отхождения от поверхности раны, что было связано с повышенной кровоточивостью раны. В дальнейшем новая повязка находилась на поверхности раны до ее полной эпителизации и отошла самостоятельно на 9-е сутки. У всех больных при использовании повязки «ЛОКУС», не было отмечено нагноения раны и образования грубых рубцов.
Таким образом, предложенный нами способ лечения донорских ран имеет следующие достоинства:
1. Пенополиуретановая повязка благодаря своей способности улучшать процессы репаративной регенерации и обеспечивать герметизацию раны за счет прилипания к здоровой коже и высокой конгруэнтности к рельефу раны, а также атравматичности создает оптимальные условия для ее заживления.
2. За счет первичных бактерицидных свойств (во время образования геля), высокой степени защиты от проникновения вторичной инфекции, данная повязка препятствует возникновению инфекционных осложнений со стороны донорской раны.
3. Абсорбирующие свойства повязки способствуют оттоку жидкости из раны.
4. Повязка обладает выраженным противоболевым эффектом что, по-видимому, связано с ее атравматичными свойствами и высокой эластичностью, все это в свою очередь создает комфортные условия для раны и больного.
5. Однократное наложение повязки облегчает уход за раной и лечение пациента, создает заметный экономический эффект.
Профилактика воспалительных осложнений мягких тканей вокруг спиц при использовании аппаратов внешней фиксации.
Лечение травматологических и ортопедических больных сегодня во многих случаях связано с применением различных аппаратов внешней фиксации. Применение этих аппаратов в большинстве своем предполагают чрескостное проведение от 8 до 16 и более спиц.
Наиболее частым осложнением при использовании чрескостного остеосинтеза является локальное воспаление мягких тканей вокруг спиц, основным фактором возникновения которого является проникновение инфекции с поверхности кожи по ходу спицевого канала в глубжележащие ткани. В ряде случаев это осложнение возникает из-за подвижности спиц в кости вследствие неправильного наложения компрессионно-дистракционного аппарата.
Нами предложен способ профилактики воспалительных осложнений при использовании аппарата внешней фиксации путем нанесения защитной повязки «ЛОКУС» вокруг спиц. Места установки спиц закрывают пенополиуретановой композицией на 3-4 недели (Пат. RU 2244564).
Предложенный способ позволяет получить следующий положительный эффект. Пенополиуретановая композиция обеспечивает герметизацию раны и позволяет создать оптимальные условия для ее заживления. За счет антибактериальных свойств пенополиуретановая композиция сохраняет в местах входа и выхода спиц практически стерильные условия в момент ее нанесения, что предотвращает возникновение воспалительных процессов. Абсорбционные свойства композиции способствуют оттоку из проколов кожи экссудата, а адгезивные качества также хорошему закреплению повязки в местах входа и выхода спиц. Выполнение повязки в форме овала или круга диаметром 1,5-2,0 см и толщиной 0,4-0,6 см позволяет не только надежно закрепиться в местах входа и выхода спиц, но и предотвращает их излишнюю подвижность. Наложение повязки на 3-4 недели облегчает уход за аппаратом и не создает неудобств пациенту, а также позволяет получить выраженный экономический эффект.
Предложенный способ осуществляют следующим образом.
После проведения спиц готовят пенополиуретановую композицию, как описывалось выше. Далее полиуретановый гель наносится в местах входа и выхода спиц или стержней с формированием овальных «лепешек» диаметром 1,5-2,0 см, толщиной 0,4-0,6 см.
Профилактика и лечение дерматита при свищах желудочно-кишечного тракта
Вопрос защиты кожи и профилактики дерматита при свищах желудочно-кишечного тракта имеет очень большое значение как в плане подготовки больного к операции, так и в повседневном уходе за ним. Это связано с тем, что инфекция, всегда имеющаяся вокруг свища и попадающая на мацерированную кожу, может серьезно осложнить течение заболевания и послеоперационный период.
Для защиты кожи нами предложено использовать повязку «ЛОКУС», которая накладывается вокруг свища, хорошо прилипает к коже и не дает возможности проникать под нее кишечному содержимому. Повязка должна быть толщиной не менее 1-1,5 см (приоритетная справка № 2003101252).
Преимущества этого способа защиты кожи при свищах желудочно-кишечного тракта заключаются в том, что, во-первых, он является более надежным, препятствует поступлению содержимого свища на здоровую кожу, во-вторых, технически прост в осуществлении, в-третьих, защитное покрытие держится долго и исключается его ежедневная замена, в-четвертых, при намокании и набухании повязка легко снимается и, в-пятых, облегчается уход за свищом.
В Ы В О Д Ы
1. Для получения гелеобразной пенополиуретановой повязки должны использоваться: полиольный компонент А, содержащий высокомолекулярный простой полиэфирполиол, активационную смесь, включающую воду, катализатор уретанообразования и удлинитель цепи полиуретана, порооткрыватель, пеноотвердитель; изоцианатный компонент Б, содержащий олигоуретаноизоцианаты в избытке смеси изомеров дифенилметандиизоцианата. Соотношение компонента А и компонента Б составляет 3 : 1, что позволяет получить гелеобразную быстрозастывающую повязку из эластичного пенополиуретана с оптимальными сроками ее полимеризации и температурного режима.
2. Полимер, образующийся на ране, включает 4 функциональные зоны. Первая зона представляет собой отвержденный полиуретан, защищает рану от проникновения вторичной инфекции, но одновременно проницаема для воздуха и пара. Вторая зона, состоящая из вспененного открытоячеистого полиуретана, выполняет функцию сорбента и обладает термоизоляционными свойствами. Третья зона имеет высокие адгезивные свойства по отношению к сухим поверхностям, что позволяет повязке надежно фиксироваться к здоровой коже и за счет этого дополнительно защищать рану от вторичной инфекции. Четвертая зона, обогащенная полимочевиной, обладает низкой адгезией, что позволяет удалять повязку безболезненно, не повреждая грануляций и молодого эпителия, полимочевина - гидрофобна, поэтому в ране сохраняется влажная среда, несмотря на высокую сорбцию второго слоя, а сохранение влаги создает условия для улучшения регенерации тканей.
3. Образующийся на ране пенополиуретан не токсичен, и в момент нанесения обладает бактерицидными свойствами в отношении большинства видов микроорганизмов, высеваемых с поверхности гнойных ран.
4. Повязка «ЛОКУС» усиливает капиллярный кровоток в месте ее нанесения.
5. При лечении больных с применением повязки «ЛОКУС» происходит заметное усиление регенераторных способностей тканей, что приводит к сокращению сроков заживления длительно незаживающих ран на 34 суток, трофических язв – на 46 суток.
6. С целью создания лучших условий для регенерации тканей и усиления бактерицидного эффекта под повязку в качестве прокладки показано использование различных лекарственных средств и в частности ксимедона, в виде 5-10% присыпки с 90-95% талька.
7. Доказана высокая эффективность повязки «ЛОКУС» при лечении больных с поверхностными ожогами, заживление которых под ней происходит, при ожогах II степени – на 3 суток, при ожогах IIIА степени - на 7 суток раньше, чем в контрольных группах.
8. Показана возможность эффективного использования повязки «ЛОКУС» для лечения больных с пролежнями, для закрытия донорских ран, профилактики воспалительных осложнений со стороны мягких тканей вокруг спиц для скелетного вытяжения, защиты кожи вокруг свищей желудочно-кишечного тракта, укрепления дренажей и катетеров.
9. Повязка из ППУ может успешно применяться в военно-полевых условиях на этапах оказания первой врачебной, квалифицированной и специализированной помощи и в чрезвычайных обстоятельствах при ликвидации последствий катастроф.
Практические рекомендации
1. Пенополиуретановая повязка «ЛОКУС» готовится непосредственно перед наложением путем перемешивания двух ее компонентов через оболочку прилагаемого пакета. Готовность к ее применению определяется равномерным вспениванием и начинающимся увеличением ее объема. Она должна накладываться на рану быстро и равномерно концентрическими движениями от центра на периферию с захватом здоровой кожи вокруг раны на 2 см от ее границ. Затекание пены на указанные границы вполне допускается. Не рекомендуется удалять излишки пены до полного застывания повязки.
2. Перед наложением повязки необходим тщательный туалет раневой поверхности с максимальным удалением нежизнеспособных тканей. Кожа вокруг раны должна быть обработана спиртовым раствором хлоргексидина или любого другого антисептика, после чего ее необходимо просушить. Гиперкератозные разрастания должны быть удалены с помощью скальпеля. Раневая поверхность и омозолелые края во время нанесения геля должны быть увлажнены физиологическим раствором.
3. Повязку не следует накладывать на раны с обильным гноетечением и признаках синегнойной и анаэробной инфекции.
4. После наложения повязки на гнойную рану необходимо ежедневное врачебное наблюдение, если повязка отслаивается от раневой поверхности и из-под нее подтекает раневое отделяемое, то ее необходимо удалить. Удаление повязки производится путем медленного отделения от кожи за любой край, при этом от раны она отходит безболезненно. За тем произвести туалет раны, обработать тем или иным антисептиком, или мазью на водорастворимой основе и затем можно снова наложить ПГБ – «ЛОКУС». Если повязка не отслаивается, и из-под нее нет подтекания раневого содержимого, нет гиперемии кожи вокруг, то повязка может находиться на раневой поверхности от 3 до 7 суток или до самостоятельного отторжения.
5. При лечении трофических язв, развившихся на фоне ХВН, с целью уменьшения возможной болевой реакции, особенно при первичном применении повязки, поверхность язвы необходимо обработать 10% раствором лидокаина.
6. Для усиления лечебного эффекта целесообразно перед наложением повязки раневую поверхность припудрить 10% присыпкой ксимедона.
7. Повязка «ЛОКУС» может быть рекомендована для лечения больных с поверхностными ожогами II и IIIА степени, длительно незаживающими ранами и трофическими язвами любой этиологии, пролежнями, донорскими ранами, для профилактики воспалительных осложнений со стороны мягких тканей вокруг спиц для скелетного вытяжения, защиты кожи вокруг свищей желудочно-кишечного тракта, укрепления дренажей и катетеров.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ
- Применение гелеобразной пенополиуретановой композиции в качестве лечебно-защитной повязки при лечении ожогов. // Травматология и ортопедия России. - 1994.- № 4. - С. 45-50. (соавт. В.А.Жегалов, С.П.Пахомов, Е.Е. Мусатова)
- Пенополиуретановая композиция для перевязочного материала. Ю.И.Дергунов, В.Н.Анисимов.// Изобретения (заявки и патенты). 1996.- Бюл. № 32. – С. 168. (соавт. Ю.И.Дергунов, В.Н.Анисимов)
- Некоторые хирургические проблемы медицины катастроф и перспективы их решения.//Военно-медицинский журнал. – 1999.- № 5.- С. 16-20. (соавт. В.Н. Анисимов, А.Г. Ботяков)
- Возможности использования пенополиуретановой повязки. //Нижегородский медицинский журнал.-2003.-№ 2.-С. 78-83. (соавт. И.В. Подушкина, Д.В. Казнин).
- Опыт применения повязки нового поколения – «Жидкий бинт». // Вестник новых медицинских технологий. – 2004 – Т. XI. № 4.- С. 115-118.
- Способ лечения донорских ран. // Изобретения полезные модели. – 2004.- Бюл. № 21 – Ч.1.- С. 87. (соавт. Ю.И. Дергунов, И.В. Подушкина, Д.В. Казнин)
- Способ профилактики и лечения околосвищевого дерматита.// Изобретения полезные модели. – 2004.- Бюл. № 21 – Ч.1.- С. 87-88. (соавт. Ю.И. Дергунов, И.В. Подушкина)
- Способ лечения плоскостных ран и трофических язв. // Изобретения полезные модели. – 2004.- Бюл. № 31 – Ч.1.- С. 55. (соавт. Ю.И. Дергунов, И.В. Подушкина).
- Медицинская повязка. // Изобретения полезные модели. – 2005.- Бюл. № 3. – Ч.3.- С.545. (соавт. Ю.И. Дергунов, В. Н. Анисимов).
10. Способ профилактики воспалительных осложнений мягких тканей вокруг спиц при использовании аппарата внешней фиксации. // Изобретения полезные модели. – 2005.- Бюл. № 2. – Ч.3.- С. 435. (/А.А. Куранов, Ю.И. Дергунов, И.В. Подушкина).
11. Пенополиуретановая повязка САРЭЛ в хирургии.//Н.Новгород. НГМА. -2003.- 64 с. (соавт. В.Н. Анисимов, Ю.И. Дергунов, А.А. Куранов, И.В. Подушкина, Д.В. Казнин).
12.Лечение ран мягких тканей. // Монография.- М., «Граница». – 1995.- 57 с. (соавт. В.Н. Анисимов, А.А. Куранов.А.Г. Ботяков, А.В. Воробьев, В.Н. Гречко).
13.Гнойные заболевания пальцев и кисти. //Монография. Н.Новгород, НГМА. – 2002. – 92 с. (С.Г. Измайлов, Г.А. Измайлов, М.Ю. Аверьянов, А.А. Куранов, Ю.А. Аверьянов).
14.Лечение ран мягких тканей достижения и перспективы. // Вестник РАЕН. Н.Новгород. - 1997. - № 1. – С. 101-109. ( В.Н. Анисимов, А.А. Куранов. А. Г. Ботяков, А.В. Воробьев, В.Н. Гречко).
15. Первый опыт лечения донорских ран под повязкой "Пенопур".//Материалы научно-практической конференции посвященные 80-тилетию Дорожной клинической больницы ГЖД МПС РФ 19.09.2002. "Актуальные проблемы железно-дорожной и военной медицины". Н.Новгород.-2002.-С. 207. (соавт. А.А. Куранов, И.В. Подушкина, Д.В. Казнин).
16. . Опыт применения повязки «ЛОКУС» для местного лечения диабетических поражений стоп. //Тезисы сетевой конференции хирургов. Муром.-2004.- с. 165.
17. Результаты изучения эффективности повязки «ЛОКУС» в эксперименте. // Тезисы сетевой конференции хирургов. Муром.-2004.- с. 166 – 168.
18. Создание повязки «жидкий бинт». (Повязка гелеобразная быстрозастывающая для закрытия ран и ожогов – ПГБ САРЭЛ). //Тезисы сетевой конференции хирургов. Муром.-2004.- с. 168-169.
19. Пенополиуретановая повязка в лечении больных с трофическими язвами и ожогами. //Труды международного хирургического конгресса "Актуальные проблемы современной хирургии". Москва.- 2003.- С 197.
20.Применение повязки «ЛОКУС» в травматологии. // Материалы VIII - го Российского национального конгресса "Человек и его здоровье". СПб -2003.- С. 234 – 236.
21. Применение повязки «ЛОКУС» в лечении венозных трофических язв. // Труды международного конгресса хирургов. "Актуальные проблемы современной хирургии" Москва. 2003.-С 167.
22. Лечение длительно незаживающих ран и трофических язв с помощью повязок из двукомпонентного пенополиуретана. // Материалы юбилейной XXV научно-практической конференции врачей Московского военного округа Н.Новгород.- 1994.- С. 81.
23. Сравнительная оценка различных методов лечения трофических дефектов нижних конечностей при облитерирующих заболеваниях артерий.//Материалы научно-практической конференции медицинского состава ФПС России: «Современные методы лечения ран мягких тканей», - Нижний Новгород.- 2000. – С. 5-6.
24. Перспективы использования повязки «Пенопур» для лечения ран мягких тканей.//Материалы научно-практической конференции медицинского состава ФПС России: «Современные методы лечения ран мягких тканей», - Нижний Новгород.- 2000. – С. 4-5.
25. Острая кишечная непроходимость. – Н.Новгород.- НГМА. – 2005.- с.106. (соавт. С.Г. Измайлов, Э.И. Романов, В.В. Ершов).
26. Профилактика воспалительных осложнений вокруг спиц для скелетного вытяжения. // Материалы IX - го Российского национального конгресса "Человек и его здоровье". СПб -2004.- С 57.
27. Применение двухкомпонентных пенополиуретановых повязок для лечения ожогов и ран мягких тканей.: Методические рекомендации. Н. Новгород. – 1993. - 5 с. (соавт. В.А. Жегалов, Е.З. Журавлев).
28. Организация оказания хирургической помощи в санитарном вагоне восстановительного поезда. //Методические рекомендации. Н. Новгород. – 1994. – 22 с.(А.Г. Ботяков, Г.П. Кочетов, Ю.В. Величко).
Список изобретений и рационализаторских предложений по теме диссертации
1. Пат. 2069219 Российская Федерация. МПК С 08 L 75/08. Полиуретановая композиция для перевязочного материала. от 20.11.1996 (соавт. Ю.И. Дергунов, Е.З. Журавлев, В.Н. Анисимов и др.).
2. Пат. 2244564 Российская Федерация. МПК 7 А 61 L 15/16, 15/34. Способ профилактики воспалительных осложнений вокруг спиц при использовании аппарата внешней фиксации . 20.01.2005 г. (соавт. Дергунов Ю.И. , И.В. Подушкина, В.Н. Анисимов, В.П. Куликов).
3. Пат. 2245164 Российская Федерация. МПК 7A 61 L 15/26, A 61 F 13/15 Медицинская повязка 27.01.2005. (соавт. Дергунов Ю.И. , В.Н. Анисимов).
4. Приор. спр. 2003101199 от 17.01.2003. Способ лечения донорских ран. (соавт. В.Н. Анисимов, И.В. Подушкина, Д.В. Казнин).
5. Приор. спр. 2003111132 от 17.01.2003. Способ лечения плоскостных ран и трофических язв. (соавт. В.Н. Анисимов, И.В.Подушкина).
6. Приор. спр. 20031011252 от 17.01.2003. Способ профилактики и лечения околосвищевого дерматита (В.Н. Анисимов, И.В.Подушкина).
7. Способ лечения длительно незаживающих ран и трофических язв с помощью повязки из пенополиуретана. - Удостоверение на рационализаторское предложение № 555 от 24.01.94 г. Выдано ВМедФ при НГМИ.
8. Способ лечения кишечных свищей с помощью двукомпонентного пенополиуретана. - Удостоверение на рационализаторское предложение № 556 от 24.01.94 г. Выдано ВМедФ при НГМИ.
9. Способ улучшения абсорбционных и бактерицидных свойств "Пенопура". - Удостоверение на рационализаторское предложение № 557 от 24.01.94 г. Выдано ВМедФ при НГМИ.
10. Способ лечения донорских ран. Удостоверение на рационализаторское предложение № 1385 от 14 марта 2003 г. Выдано ВМИ ФПС РФ при НГМА
11. Устройство для нанесения гелеобразной пенополиуретановой повязки на донорские раны. Удостоверение на рационализаторское предложение № 1381 от 14 марта 2003 г. Выдано ВМИ ФПС РФ при НГМА
12. Способ лечения гнойных ран с применением озонирования компонента А в пенополиуретановой повязке. - Удостоверение на рационализаторское предложение № 1386 от 14 марта 2003 г. Выдано ВМИ ФПС РФ при НГМА.
13. Способ лечения плоскостных ран и трофических язв. - Удостоверение на рационализаторское предложение № 1381 от 14 марта 2003 г. Выдано ВМИ ФПС РФ при НГМА.
14. Способ крепления дренажей и катетеров. - Удостоверение на рационализаторское предложение № 1387 от 14 марта 2003 г. Выдано ВМИ ФПС РФ при НГМА.
15. Способ герметизации плевральной полости при открытых пневмотораксах. - Удостоверение на рационализаторское предложение № 1574 12 декабря 2004 г. Выдано ВМИ ФПС РФ при НГМА.
16. Способ лечения трофических язв венозной этиологии. - Удостоверение на рационализаторское предложение № 1575 от 12 декабря 2004 г. Выдано ВМИ ФПС РФ при НГМА.
17. Способ профилактики образования потертостей при пользовании протезами нижних конечностей. - Удостоверение на рационализаторское предложение № 1577 от 12 марта 2004 г. Выдано ВМИ ФПС РФ при НГМА.